题目内容
【题目】环己烯是重要的有机合成原料,常用作高辛烷值汽油稳定剂。其实验室制备流程如下:
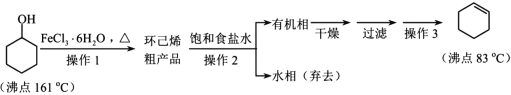
请回答下列问题:
(1)实验室用FeCl3 溶液制备 FeCl3·6H2O 的方法是__________。
(2)操作 1 的装置如图所示(加热和夹持装置已略去)。
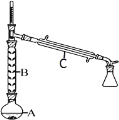
①仪器B的作用为_________。
②烧瓶A中进行的可逆反应化学方程式为_______
(3)浓硫酸也可作该反应的催化剂,选择 FeCl3·6H2O 而不用浓硫酸的原因为________(填选项)。
A.浓硫酸易使原料碳化并产生 SO2
B.FeCl3·6H2O 污染小、可循环使用,符合绿色化学理念
C.同等条件下,用 FeCl3·6H2O 比浓硫酸的平衡转化率高
(4)操作2用到的玻璃仪器是____________。
(5)环己烯含量的测定:在一定条件下,向 a g 环己烯样品中加入定量制得的b mol Br2, 与环己烯充分反应后,剩余的 Br2 与 足 量 KI 作用生成 I2 ,用 c molL-1 的 Na2S2O3标准溶液滴定,终点时消耗 Na2S2O3 标准溶液 v ml(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①![]() +Br2→
+Br2→![]()
② Br2+ KI=I2 + 2KBr
③ I2 + 2Na2S2O3=2 NaI+ Na2S4O6
滴定所用指示剂为_____________________ ;样品中环己烯的质量分数为_________________(用字母表示)。
【答案】在HCl气流下蒸发溶液 减少环己醇蒸出、冷凝回流 
![]()
 +H2O AB 分液漏斗和烧杯 淀粉溶液
+H2O AB 分液漏斗和烧杯 淀粉溶液 
【解析】
(1)FeCl3在水中易发生水解反应,故在制备FeCl3·H2O时需要在HCl气流下蒸发溶液;
(2)①仪器B为冷凝管,其作用为减少环己醇蒸出、冷凝回流;
②化学方程式为
![]()
 +H2O;
+H2O;
(3)烧瓶中进行的可逆反应是环己醇在氯化铁作用下转化为环己烯。若用浓硫酸作反应的催化剂,由于浓硫酸的强氧化性,易使原料碳化并产生二氧化硫,A正确;使用氯化铁晶体污染小,而选择浓硫酸时,反应后有大量硫酸需要处理,不易回收利用,B正确;催化剂的使用不影响平衡转化率,C错误;故选AB;
(4)操作2用到的玻璃仪器有分液漏斗和烧杯;
(5)用硫代硫酸钠滴定I2时,需要选择合适的指示剂,应选用淀粉溶液做指示剂,当I2与硫代硫酸钠溶液完全反应后,溶液中无I2,溶液颜色由蓝色变为无色;根据反应②③可得过量的Br2和Na2S2O3的关系式为Br2~2Na2S2O3,所以n(Br2)=5cv![]() 10-4mol,所以与环己烯反应的n(Br2)=(b-5cv
10-4mol,所以与环己烯反应的n(Br2)=(b-5cv![]() 10-4)mol,即n(环己烯)= (b-5cv
10-4)mol,即n(环己烯)= (b-5cv![]() 10-4)mol。故样品中环己烯的质量分数为(b-5cv
10-4)mol。故样品中环己烯的质量分数为(b-5cv![]() 10-4)
10-4)![]() 82g
82g![]() ag=
ag= 。
。

 学习实践园地系列答案
学习实践园地系列答案