题目内容
19.Mg3N2是一种在工业上应用非常广泛的离子化合物,呈微黄色,遇水发生水解反应,需密封保存.某化学兴趣小组利用如下装置制取氮气,并用氮气制备Mg3N2.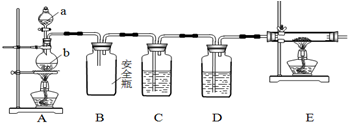
(1)装置A中仪器a和b的名称分别是分液漏斗、圆底烧瓶.
(2)已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气.写出该反应的化学方程式NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O.
(3)装置D中所装的试剂名称是浓硫酸,实验开始时,需要排除装置内的空气,为了达到此目的,在装置C中盛放了酸性氯化亚铁溶液,该装置中发生反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O. C、D装置能否对调不能(填“能”或“不能”).
(4)实验结束后,取装置E的硬质玻璃管中的少量固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,观察实验现象,该操作的目的是证明产物中是否有Mg3N2生成;再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是证明产物中是否含有未反应的镁.
(5)写出E装置中反应的方程式3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;Mg3N2的电子式
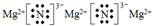 .
.
分析 A装置制备氮气,B为安全瓶,防止C中的溶液倒吸进入A中,C中放氯化亚铁是为了检验装置中的空气是否除尽,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应先用氮气排尽装置内空气后再制备氮化镁,
(1)根据装置的构造判断仪器的名称,a为分液漏斗,b为圆底烧瓶;
(2)饱和氯化铵溶液与亚硝酸钠晶体混合加热制备氮气,根据氮元素化合价的升降守恒书写方程式;
(3)产生的氮气需干燥才能通入玻璃管中反应,D为干燥氮气的装置,C为了检验装置中的空气是否除尽;
(4)固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,目的是验证产物中是否有Mg3N2生成,弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是验证产物中是否含有未反应的镁,
(5)E装置为氮气与镁高温加热发生反应生成氮化镁的装置,氮化镁为离子化合物.
解答 解:A装置制备氮气,B为安全瓶,防止C中的溶液倒吸进入A中,C中放氯化亚铁是为了检验装置中的空气是否除尽,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应先用氮气排尽装置内空气后再制备氮化镁,
(1)装置A中的a为分液漏斗,b为圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)饱和氯化铵溶液与亚硝酸钠晶体混合加热制备氮气,根据氮元素化合价的升降守恒,反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,
故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
(3)产生的氮气需干燥才能通入玻璃管中反应,D为干燥氮气的装置,选用浓硫酸作干燥剂;C中放氯化亚铁是为了检验装置中的空气是否除尽,若有氧气,二价铁会被氧化为三价铁,反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,CD不能交换位置,如果交换,出来的氮气会带有水蒸气,进入E中会导致玻璃管炸裂,
故答案为:浓硫酸;4Fe2++O2+4H+═4Fe3++2H2O;不能;
(4)固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,观察实验现象,该操作的目的是验证产物中是否有Mg3N2生成,若有,则氮化镁水解产生的氨气遇到试纸变蓝;弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是验证产物中是否含有未反应的镁,若有应该产生气泡,
故答案为:证明产物中是否有Mg3N2生成;证明产物中是否含有未反应的镁;
(5)E装置为氮气与镁高温加热发生反应生成氮化镁的装置,反应的方程式为3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2,氮化镁的电子式为,
故答案为:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;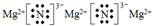 .
.
点评 本题考查物质制备实验、物质含量测定等,关键是对制备原理与各装置的理解,注意制备中避免水解及杂质生成,题目综合考查学生对知识的迁移运用、分析能力、实验能力等,掌握元素化合 物性质与实验制备原则.

| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C2H6 | D. | C2H2和C2H6 |
①Ca(HCO3)2②Al(OH)3③NaAlO2④(NH4)2CO3 ⑤Al.
| A. | ①④ | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
| A. | 常温常压下,60gCH3COOH中含共用电子对数为7NA | |
| B. | 56g聚乙烯含有的碳原子数为4NA | |
| C. | 2molSO2和1molO2在密闭容器中充分反应后,容器内物质分子数等于2NA | |
| D. | 2L0.5mol/L乙酸溶液中H原子数为0.1NA |
 的物质是( )
的物质是( )| A. | 丙烷 | B. | 丁烷 | C. | 丙烯 | D. | 丁烯 |
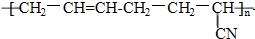 具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )
具有优良的耐油、耐高温性能,则合成丁晴橡胶的单体种类和化学反应所属类型分别是( )| A. | 1种 加聚反应 | B. | 2种 缩聚反应 | C. | 2种 加聚反应 | D. | 3种 缩聚反应 |

 、
、 .
. .
.