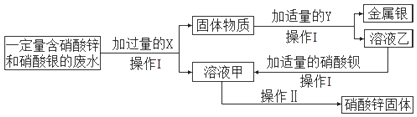
题目内容
7.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 一定条件下,将1molN2和3molH2混合发生反应,转移的电子总数为6NA | |
| B. | 1L0.1mol•L-1的Na2CO3溶液中阴离子的总数大于0.1NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2molFe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1mol-CH3中所含的电子总数为10NA |
分析 A.合成氨为可逆反应,可逆反应不能进行到底;
B.碳酸根离子为弱酸根离子,部分水解生成碳酸氢根离子和氢氧根离子;
C.碘离子还原性强于二价铁离子,氯气先氧化碘离子再氧化二价铁离子;
D.1个甲基含有9个电子.
解答 解:A.将1molN2和3molH2混合发生反应生成氨气,因为该反应为可逆反应,所以氮气与氢气不能全部转化为氨气,则转移的电子总数小于6NA,故A错误;
B.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,阴离子数增多.1L0.1mol/LNa2CO3溶液中阴离子总数大于0.1NA,故B正确;
C.向FeI2溶液中通入适量Cl2,当有2molFe2+被氧化说明碘离子全部被氧化,则消耗Cl2的分子数大于NA,故C错误;
D.1mol-CH3中所含的电子总数为9NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的应用,主要阿伏伽德罗定律应用,盐类水解的分析,氧化还原反应电子转移计算,质量换算物质的量计算微粒数的方法,题目难度中等.

练习册系列答案
相关题目
18.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为1.1NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 2.3 g金属钠与O2完全反应,转移电子的物质的量为0.1mol |
2.下列溶液中微粒浓度关系正确的是( )
| A. | 常温下将pH=12的氨水加水稀释,稀释过程中溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 同浓度的醋酸钠和醋酸等体积混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃相同pH的①CH3COONa②NaHCO3③NaAlO2三种溶液中的c(Na+):①>②>③ | |
| D. | 浓度均为0.1mol•L-1的KHS和HCl等体积混合液中:c(HS-)+c(H2S)=0.1mol•L-1 |
12.NA表示阿伏加德罗常数数值,下列有关说法正确的是( )
| A. | 18.4 mol/L的浓硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 50 mL 14.0 mol•L-1浓硝酸与足量铜反应,转移的电子数为0.35 NA | |
| D. | 同温同压同体积下的两种气体12C18O和14N2具有的电子数相等 |
6.下列物质的主要成分属于天然有机高分子的是( )
| A. | 水泥 | B. | 木材 | C. | 陶瓷 | D. | 铝合金 |
3.下列有关说法或做法错误的是( )
| A. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |
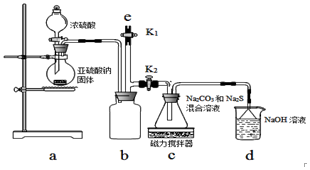 氰化钠是一种重要的基本化工原料.泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
氰化钠是一种重要的基本化工原料.泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.