题目内容
18.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为1.1NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 2.3 g金属钠与O2完全反应,转移电子的物质的量为0.1mol |
分析 A.常温常压Vm大于22.4L/mol;
B.依据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$结合1个铵根离子含有10个电子计算解答;
C.计算两种气体的物质的量,结合二氧化碳为三原子分子,氢气为双原子分子计算解答;
D.钠为1价金属,2.3g钠的物质的量为0.1mol,完全反应失去了0.1mol电子.
解答 解:A.常温常压Vm大于22.4L/mol,则11.2 L氧气所含的分子数为小于0.5NA,故A错误;
B.1.8 g 的NH4+中含有的电子数为$\frac{1.8g}{18g/mol}$×10×NA=NA,故B错误;
C.22g二氧化碳的物质的量为0.5mol,含有原子物质的量为1.5mol,标准状况下11.2LH2的物质的量为0.5mol,含有的原子2mol,依据N=nNA,可知二者含有原子数不相等,故C错误;
D.2.3g钠的物质的量为0.1mol,0.1mol钠完全反应失去0.1mol电子,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的判断及计算,掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系是解题关键,题目难度中等,注意气体摩尔体积使用条件和对象.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
8.合成导电高分子化合物PPV的反应为:
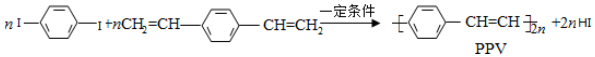
下列说法正确的是( )
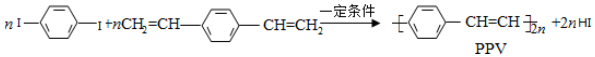
下列说法正确的是( )
| A. | 1 mol 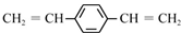 最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 | |
| B. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| C. | 该反应为缩聚反应 | |
| D. | PPV是聚苯乙炔 |
9.化学与材料、生活和环境密切相关,下列有关说法中错误的是( )
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 |
6.下列物质不能与氢氧化钠溶液反应的是( )
| A. | Al | B. | Fe2O3 | C. | Ca(HCO3)2 | D. | Al(OH)3 |
3.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
10.地球表面十公里厚的地层中,含钛元素达千分之六,比铜多61倍,金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系,列反应可以制得Ti3N4和纳米TiO2(如图1).
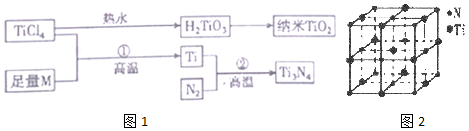
图中的M是短周期金属元素,M的部分电离能如表:
请回答下列问题:
(1)TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为1s22s22p63s23p6
(2)金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为六方最密堆积 (填写堆积模型名称),晶体中原子在二维平面里的配位数为6
(3)室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为分子晶体,构成该晶体的粒子的空间构型为正四面体
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如2图所示,已知该氮化钛的密度为p g•cm-3,则该晶胞中N、Ti之间的最近距离为$\frac{1}{2}\root{3}{\frac{4×62}{ρ{N}_{A}}}×1{0}^{10}$ pm,(NA为阿伏加德常数的数值,只列算式).该晶体中与Ti原子距离相等且最近的Ti原子有12 个.
(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如表:
KC1、CaO、TiN三种离子晶体硬度由低到该的顺序为KCl<CaO<TiN.

图中的M是短周期金属元素,M的部分电离能如表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ•mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
(1)TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为1s22s22p63s23p6
(2)金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为六方最密堆积 (填写堆积模型名称),晶体中原子在二维平面里的配位数为6
(3)室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为分子晶体,构成该晶体的粒子的空间构型为正四面体
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如2图所示,已知该氮化钛的密度为p g•cm-3,则该晶胞中N、Ti之间的最近距离为$\frac{1}{2}\root{3}{\frac{4×62}{ρ{N}_{A}}}×1{0}^{10}$ pm,(NA为阿伏加德常数的数值,只列算式).该晶体中与Ti原子距离相等且最近的Ti原子有12 个.
(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
7.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,将1molN2和3molH2混合发生反应,转移的电子总数为6NA | |
| B. | 1L0.1mol•L-1的Na2CO3溶液中阴离子的总数大于0.1NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2molFe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1mol-CH3中所含的电子总数为10NA |
15.实验室用氢气还原氧化铜,正确的操作顺序是( )
| A. | 加热、通氢气、停止加热、继续通氢气至试管冷却 | |
| B. | 通氢气、加热、停止加热、继续通氢气至试管冷却 | |
| C. | 通氢气后立即点燃酒精灯加热 | |
| D. | 停止加热后立即停止通氢气 |