题目内容
1.氯碱工业生产主要流程如图1所示: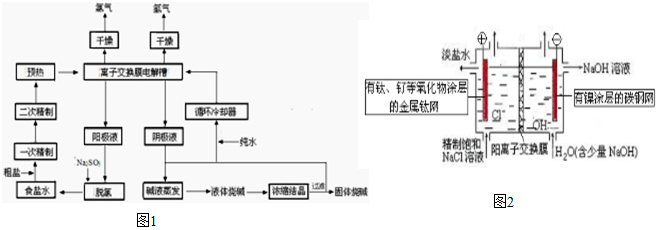
(1)脱氯工序中的离子方程式为SO32-+Cl2+H2O═SO42-+Cl-+2H+.
Ⅰ、食盐水的精制
(2)一次精制:粗盐中含有Ca2+、Mg2+、Fe3+、SO42-,第一步加过量的BaCl2除SO42-,第二步加过量Na2CO3除Ca2+、Ba2+,第三步加过量NaOH除Fe3+和Mg2+,过滤后用盐酸中和.
(3)二次精制:经一次精制后的盐水中仍含少量Ca2+、Mg2+,若不除去,电解过程中造成的危害是与电解生成的OH-反应生成难溶氢氧化物,因此必须C被除去(填编号).
A.分别加入Na2CO3和NaOH B.加入适量盐酸 C.送入阳离子交换塔
Ⅱ、离子交换膜法电解装置(如图2):
(4)将进入电解槽的精制饱和食盐水预热至80~90℃,其目的是增大溶液的导电性(或离子迁移速度加快)、减小氯气在溶液中的溶解;阳离子交换膜的作用有让Na+通过使膜两边溶液呈电中性、防止氢氯混合发生爆炸、防止氯气与NaOH反应生成NaClO和NaCl影响烧碱的质量.
(5)某工厂用电流强度为1.45×104A的电解槽生产8小时,制得32.0%的烧碱溶液0.507t,则该厂电解的电流效率为93.7%(1mol e-的电量取9.65×104C).
分析 (1)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(2)根据粗盐中含有的杂质离子,除去硫酸根离子用过量的钡离子,除去过量的钡离子和钙离子使用碳酸钠试剂,除去镁离子和铁离子使用氢氧化钠试剂;
(3)根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;粗盐经过加入碳酸钠和氢氧化钠精制后含有少量的钙离子和镁离子根据题意只能通过阳离子交换塔除去;
(4)温度升高气体的溶解性减小,离子迁移速度加快,增大溶液的导电性;由于电解时在阴极消耗水电离产生的氢离子氢氧根离子的浓度增大阳离子交换膜让Na+通过使膜两边溶液呈电中性;生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜阻止上述情况的发生.
(5)根据反应2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,当制得32.0%的烧碱溶液0.507t即生成NaOH的物质的量为4056mol时,反应中需要转移的电子的物质的量为4056mol,在实际生产中消耗的电子的物质的量为3600 s/h×8 h×1.45×104C/s÷96500 C/mol=4327.5mol,根据电流效率=$\frac{需要转移的电子的物质的量}{实际生产中消耗的电子的物质的量}$×100%计算.
解答 解:(1)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,反应的离子方程式为SO32-+Cl2+H2O═SO42-+Cl-+2H+,
故答案为:SO32-+Cl2+H2O═SO42-+Cl-+2H+;
(2)根据粗盐中含有的杂质离子,除去硫酸根离子用过量的钡离子,除去过量的钡离子和钙离子使用碳酸钠试剂,除去镁离子和铁离子使用氢氧化钠试剂,
故答案为:Ca2+、Ba2+(多答Fe3+不扣分)、Mg2+;
(3)处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,与电解生成的OH-反应生成难溶氢氧化物,堵塞阳膜孔隙,粗盐经过加入碳酸钠和氢氧化钠精制后含有少量的钙离子和镁离子根据题意只能通过阳离子交换塔除去,故选C,
故答案为:与电解生成的OH-反应生成难溶氢氧化物;C;
(4)温度升高气体的溶解性减小,离子迁移速度加快,增大溶液的导电性,由于电解时在阴极消耗水电离产生的氢离子氢氧根离子的浓度增大阳离子交换膜让Na+通过使膜两边溶液呈电中性,生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜可以阻止上述情况的发生,
故答案为:增大溶液的导电性(或离子迁移速度加快)、减小氯气在溶液中的溶解;让Na+通过使膜两边溶液呈电中性、防止氢氯混合发生爆炸、防止氯气与NaOH反应生成NaClO和NaCl影响烧碱的质量;
(5)根据反应2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,当制得32.0%的烧碱溶液0.507t即生成NaOH的物质的量为4056mol时,反应中需要转移的电子的物质的量为4056mol,在实际生产中消耗的电子的物质的量为3600 s/h×8 h×1.45×104C/s÷96500 C/mol=4327.5mol,所以电流效率=$\frac{需要转移的电子的物质的量}{实际生产中消耗的电子的物质的量}$×100%=$\frac{4056mol}{4327.5mol}$×100%=93.7%,
故答案为:93.7%.
点评 本题考查氯碱工业,侧重考查学生电解原理、有关计算、氧化还原反应等知识点,明确各个电极上发生的反应,难点是离子方程式的书写,题目难中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1molOH-离子中含电子数目为10NA | |
| B. | 0.5L 0.2mol•L-1的NaCl溶液中含有的Na+数是0.1NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量约为28 g | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
 ,则1mol该物质所含有的电子的物质的量是( )
,则1mol该物质所含有的电子的物质的量是( )| A. | 14mol | B. | 15mol | C. | 26mol | D. | 27mol |
| A. | Na2O2具有强的氧化性,可以做供氧剂 | |
| B. | Na2CO3溶液呈碱性,可以清除餐具表面的油污 | |
| C. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
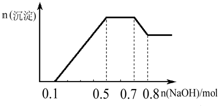
| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中一定不含CO32-,一定含有SO42-和NO3- | |
| C. | 溶液中n(NH4+)=0.2 mol | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
| A. | 2-氯丙烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 1-丁烯 |

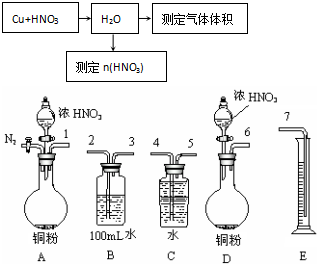


 .
. .
.