题目内容
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.2K+2H2O=2KOH+H2↑
B.Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
C.2Cu(NO3)2=2CuO+4NO2↑ +O2↑
D.3CO+Fe2O3=2Fe+3CO2
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤.取滤液;③蒸发滤液;④冷却结晶.
(1)在①、②、③、④的操作中需要用到玻璃棒是①②③(填序号).
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
(3)步骤ⅲ所得的结论,你认为是否正确?否(填是或否);为什么?加入氯化钡溶液,引入了Cl-.
(4)写出步骤ⅱ有关现象的离子方程式SO42-+Ba2+═BaSO4↓.
(1)在①、②、③、④的操作中需要用到玻璃棒是①②③(填序号).
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
| 实验步骤 | 实验现象 | 实验结论 |
ⅰ、取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中 | 气泡产生,澄清的石灰水变浑浊 | 证明含有碳酸根离子 |
| ⅱ、取第二份溶液,分别滴加稀盐酸和氯化钡 | 白色沉淀 | 证明含有硫酸根离子 |
| ⅲ、取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 证明含有氯离子. |
| ⅳ、取第四份溶液进行焰色反应 | 透过蓝色钴玻璃火焰呈紫色 | 证明含有K+ |
(4)写出步骤ⅱ有关现象的离子方程式SO42-+Ba2+═BaSO4↓.
下列反应中,相关示意图错误的是( )
A | B | C | D |
将二氧化硫通入到一定量氯水中 | 将NaHCO3溶液滴入到一定量Ba(OH)2溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|







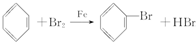
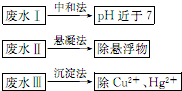 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.