题目内容
(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为 .
(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式 .
(3)NH3(g)燃烧的方程式:4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
请计算NH3(g)的燃烧热 .
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s)?2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见表.下列说法正确的是
A.若T2>T1,则该反应的△H<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的△n(T2)=2△n(T1)
(Ⅱ)海水资源的利用具有广阔前景.海水中主要离子的含量如下:
 电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
(1)阳极主要电极反应式是 .
(2)在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 .
(3)淡水的出口为 (填“a”、“b”或“c”).
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为

(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式
(3)NH3(g)燃烧的方程式:4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
请计算NH3(g)的燃烧热
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s)?2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见表.下列说法正确的是
| 温度 | 平衡浓度/(mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的△n(T2)=2△n(T1)
(Ⅱ)海水资源的利用具有广阔前景.海水中主要离子的含量如下:
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
 电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.(1)阳极主要电极反应式是
(2)在阴极附近产生少量白色沉淀,其成分有
(3)淡水的出口为
考点:化学平衡的影响因素,用盖斯定律进行有关反应热的计算,电解原理
专题:基本概念与基本理论
分析:Ⅰ.(1)根据起始和转化的物质的量进行计算;
(2)根据图示计算出反应热;
(3)根据盖斯定律进行计算;
(4)根据化学平衡的特征进行判断;
Ⅱ.依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出.
(2)根据图示计算出反应热;
(3)根据盖斯定律进行计算;
(4)根据化学平衡的特征进行判断;
Ⅱ.依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出.
解答:
解:Ⅰ.起始:n(氮气)=2mol,平衡时:n(氨气)=0.4mol/L×1L=0.4mol,则转化的氮气的物质的量为:0.4mol÷2=0.2mol,故氮气的转化率为:
×100%=10%,
故答案为:10%;
(2)△H=134kJ/mol-368kJ/mol=-234kJ/mol,故该反应的热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol;
(3)NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
Ⅰ、2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
Ⅱ、N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
Ⅲ、N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
根据盖斯定律,Ⅱ×2-Ⅲ×2+Ⅰ×3得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),△H=2×67.8kJ/mol-2×(-92.0kJ/mol)+3×(-483.6kJ/mol)=-1131.2kJ/mol,故氨气的燃烧热为
=282.8kJ/mol,
故答案为:282.8kJ/mol;
(4)A.物质的量之比等于化学计量数之比,故平衡时,氨气的浓度n(T1)=0.1mol L-1,n(T2)=0.2mol L-1,升高温度,氨气的浓度增大,平衡正向移动,说明正反应是放热,△H>0,故A错误;
B.恒容,加入氮气,对平衡不产生影响,故B错误;
C.氨气与二氧化碳的体积比是定值,故C错误;
D.物质的量之比等于化学计量数之比,故平衡时,氨气的浓度n(T1)=0.1mol L-1,n(T2)=0.2mol L-1,故H2NCOONH4转化的△n(T2)=2△n(T1),故D正确,
故答案为:D;
Ⅱ.依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出.
(1)阳极主要电极反应式是海水中的阴离子失电子发生氧化反应,氯离子放电能力大于氢氧根离子,所以电极反应为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(2)在阴极附近产生少量白色沉淀,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2,Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过一段时间海水中的阴阳离子在两个电极放电,所以水在b处流出,故答案为:b.
| 0.2mol |
| 2mol |
故答案为:10%;
(2)△H=134kJ/mol-368kJ/mol=-234kJ/mol,故该反应的热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol;
(3)NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
Ⅰ、2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
Ⅱ、N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
Ⅲ、N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
根据盖斯定律,Ⅱ×2-Ⅲ×2+Ⅰ×3得:4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),△H=2×67.8kJ/mol-2×(-92.0kJ/mol)+3×(-483.6kJ/mol)=-1131.2kJ/mol,故氨气的燃烧热为
| 1131.2kJ/mol |
| 4 |
故答案为:282.8kJ/mol;
(4)A.物质的量之比等于化学计量数之比,故平衡时,氨气的浓度n(T1)=0.1mol L-1,n(T2)=0.2mol L-1,升高温度,氨气的浓度增大,平衡正向移动,说明正反应是放热,△H>0,故A错误;
B.恒容,加入氮气,对平衡不产生影响,故B错误;
C.氨气与二氧化碳的体积比是定值,故C错误;
D.物质的量之比等于化学计量数之比,故平衡时,氨气的浓度n(T1)=0.1mol L-1,n(T2)=0.2mol L-1,故H2NCOONH4转化的△n(T2)=2△n(T1),故D正确,
故答案为:D;
Ⅱ.依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出.
(1)阳极主要电极反应式是海水中的阴离子失电子发生氧化反应,氯离子放电能力大于氢氧根离子,所以电极反应为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(2)在阴极附近产生少量白色沉淀,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2,Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过一段时间海水中的阴阳离子在两个电极放电,所以水在b处流出,故答案为:b.
点评:本题主要考查了化学平衡的有关计算、化学平衡影响因素、反应热的计算以及海水淡化的电渗析原理,综合性较强,难度很大.

练习册系列答案
相关题目
25℃时,将V1 mL 0.1mol/L NaOH溶液和V2 mL 0.1mol/L的CH3COOH溶液充分混合,若混合后溶液呈中性,则该混合溶液中有关粒子的浓度应满足的关系是( )
| A、c (Na+)=c (CH3COO-)+c (CH3COOH) |
| B、c (Na+)>c (CH3COO-) |
| C、c (Na+)+c (H+)=c (CH3COO-) |
| D、c (Na+)=c (CH3COO-) |
下列实验方案合理的是( )
| A、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体 |
| B、测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定 |
| C、用分液漏斗分离苯与硝基苯 |
| D、除去氯化铁酸性溶液中的氯化亚铁:加入适量的过氧化氢水溶液 |
部分弱酸的电离平衡常数如下表,下列选项错误的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) |
Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、CN-+H2O+CO2=HCN+HCO3- |
| B、2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
| C、中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的CH3COONa和NaCN溶液中所含离子总数前者小于后者 |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 检查气密性 |
B、 吸收HCl |
C、 制取Fe(OH)2沉淀 |
D、 稀释浓H2SO4 |
关于下列图示的说法中正确的( )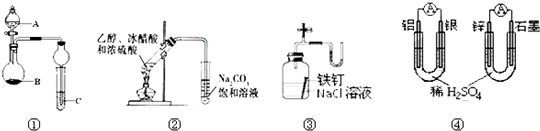

| A、图①中,若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、图②制备乙酸乙酯 |
| C、图③证明铁生锈与空气有关 |
| D、图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |

