题目内容
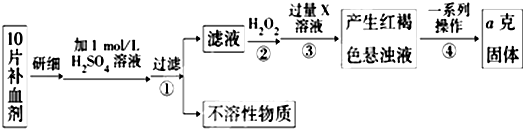
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C 、F
(2)写出下列反应的方程式:
反应①的化学方程式 .
反应③的离子方程式 .
反应⑤的离子方程式 .

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C
(2)写出下列反应的方程式:
反应①的化学方程式
反应③的离子方程式
反应⑤的离子方程式
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl
物质F→物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,据此答题.
| 金属C |
解答:
解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl
物质F→物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)由以上分析可知,C为Fe,F为FeCl2,
故答案为:Fe,FeCl2;
(2)反应①为Na和水的反应,方程式为2Na+2H2O═2NaOH+H2↑,
反应③是铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
反应⑤氯化亚铁与氯气反应生成氯化铁,反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;
故答案为:2Na+2H2O═2NaOH+H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;2Fe2++Cl2═2Fe3++2Cl-;
| 金属C |
(1)由以上分析可知,C为Fe,F为FeCl2,
故答案为:Fe,FeCl2;
(2)反应①为Na和水的反应,方程式为2Na+2H2O═2NaOH+H2↑,
反应③是铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
反应⑤氯化亚铁与氯气反应生成氯化铁,反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;
故答案为:2Na+2H2O═2NaOH+H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;2Fe2++Cl2═2Fe3++2Cl-;
点评:本题是考查物质推断与性质、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.

练习册系列答案
相关题目
下列有关物质分类或归纳不正确的是( )
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60、C70.
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60、C70.
| A、①② | B、②③ | C、③④ | D、②④ |
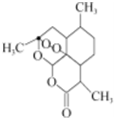 被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )
被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如下图所示.下列有关该有机物的叙述正确的是( )| A、该有机物的分子式为C14H23O5 |
| B、该有机物不能与NaOH溶液反应 |
| C、该有机物分子中含有过氧键,一定条件下具有氧化性 |
| D、该有机物易溶于水 |
在强酸性溶液中能大量共存,且溶液为无色透明的离子组( )
| A、K+、Na+、AlO2-、NO3- |
| B、NH4+、Al3+、NO3-、SO42- |
| C、K+、NH4+、SO32-、S2- |
| D、K+、Ag+、NO3-、Br- |
将1mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g)?2SO3(g).反应达到平衡时SO3为0.3mol.若此时移走0.5mol O2和0.5mol SO2,则重新达到平衡后,SO3的物质的量( )
| A、等于0.3 mol |
| B、等于0.15 mol |
| C、小于0.15 mol |
| D、大于0.15 mol,小于0.3 mol |
下列关于油脂的叙述不正确的是( )
| A、属于酯类 |
| B、没有固定的熔沸点 |
| C、是高级脂肪酸的甘油酯 |
| D、油脂的氢化属于氧化反应 |
 +CH3COOH
+CH3COOH +H2O
+H2O 注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离