题目内容
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.

请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图 .
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 .
(3)氯碱厂获得Cl2的离子方程式为 .
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可.
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大.

请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式
(3)氯碱厂获得Cl2的离子方程式为
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为
考点:物质的分离、提纯的基本方法选择与应用,离子方程式的书写,化学方程式的有关计算
专题:实验设计题,元素及其化合物
分析:(1)Fe的原子序数为26,其最外层电子数为2,有4个电子层;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO;
(3)利用电解饱和食盐水获得氯气;
(4)真空蒸馏的方法分离得到Ti,由表格中数据可知,1412℃Mg、MgCl2为气态,而Ti没有熔化;
(5)由2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO、2Cl-+2H2O
H2↑+Cl2↑+2OH-可知,14NaCl~2FeTiO3,氯气利用率最大.
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO;
(3)利用电解饱和食盐水获得氯气;
(4)真空蒸馏的方法分离得到Ti,由表格中数据可知,1412℃Mg、MgCl2为气态,而Ti没有熔化;
(5)由2FeTiO3+6C+7Cl2
| ||
| ||
解答:
解:(1)Fe的原子序数为26,其最外层电子数为2,有4个电子层,则Fe的原子结构示意图为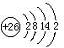 ,故答案为:
,故答案为: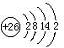 ;
;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO,故答案为:2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO;
(3)利用电解饱和食盐水获得氯气,离子反应为2Cl-+2H2O
H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O
H2↑+Cl2↑+2OH-;
(4)真空蒸馏的方法分离得到Ti,由表格中数据可知,1412℃Mg、MgCl2为气态,而Ti没有熔化,则选择温度略高于1412℃即可蒸馏分离,故答案为:1412;
(5)由2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO、2Cl-+2H2O
H2↑+Cl2↑+2OH-可知,14NaCl~2FeTiO3,氯气利用率最大,即NaCl与FeTiO3的物质的量之比为7:1,故答案为:7:1.
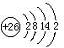 ,故答案为:
,故答案为: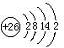 ;
;(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为2FeTiO3+6C+7Cl2
| ||
| ||
(3)利用电解饱和食盐水获得氯气,离子反应为2Cl-+2H2O
| ||
| ||
(4)真空蒸馏的方法分离得到Ti,由表格中数据可知,1412℃Mg、MgCl2为气态,而Ti没有熔化,则选择温度略高于1412℃即可蒸馏分离,故答案为:1412;
(5)由2FeTiO3+6C+7Cl2
| ||
| ||
点评:本题以物质的分离提纯流程考查化学反应、物质的分离方法及原子结构等,侧重学生分析能力及知识迁移应用能力的考查,注意习题中的信息及数据处理,(5)中注意关系式的利用,题目难度中等.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、48gO2、O3组成的混合物,在任何温度、压强下,不管混合物中各组分的比例,所含的原子数均为3NA |
| B、在标准状况下,18g水蒸气所占有的体积约为22.4 L |
| C、用浓盐酸与二氧化锰反应制取氯气,若有0.4 mol HCl被氧化,则可制得氯气4.48 L |
| D、物质的量为1mol的任何物质在任何条件下含有的微观粒子数均为1NA |
下列离子方程式书写正确的是( )
| A、Cu与FeCl3溶液反应:Cu+Fe3+=Cu2++Fe2+ |
| B、碳酸钙溶于稀盐酸:CO32-+2H+=H2O+CO2↑ |
| C、FeSO4溶液和NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ |
| D、氯气溶于水:Cl2+H2O=2H++ClO-+Cl- |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下,22.4L H2O含有的分子数为NA |
| B、28g N2和N4组成的混合气体中含有的原子数为2NA |
| C、1mol?L-1 AlCl3溶液中含有的Cl-数目为3NA |
| D、2.3g Na与足量水反应,转移的电子数目为0.2NA |
下列反应的离子方程式正确的是( )
| A、铜和稀盐酸反应:Cu+2H+=Cu2++H2↑ | ||
B、碳酸氢钠溶于盐酸反应:CO
| ||
| C、钠与水反应:Na+H2O=Na++OH-+H2↑ | ||
D、Ba(OH)2溶液与H2SO4溶液反应:Ba2++2H++2OH-+SO
|

 .
. 氢氟酸能腐蚀玻璃.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸能腐蚀玻璃.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.