题目内容
3.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下.下列说法不正确的是( )
| A. | 溶液中OH-向电极a移动 | |
| B. | O2在电极b上发生还原反应 | |
| C. | 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
分析 Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.因为a极为负极,则溶液中的阴离子向负极移动,故A正确;
B.氧气在b极发生还原反应,则b极为正极,a极为负极,故B正确;
C.负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故C正确;
D.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故D错误.
故选D.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.

练习册系列答案
相关题目
13.下列溶液中能用来区别SO2和CO2气体的是( )
①石灰水
②H2S溶液
③酸性KMnO4
④氯水
⑤品红溶液
⑥紫色石蕊试液.
①石灰水
②H2S溶液
③酸性KMnO4
④氯水
⑤品红溶液
⑥紫色石蕊试液.
| A. | ①②③⑤ | B. | ①⑥ | C. | ① | D. | ②③④⑤ |
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | 明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| B. | 氧化镁熔点高,可用于耐高温材料 | |
| C. | 碳酸钠具有碱性,可用于胃酸中和剂 | |
| D. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 |
11.下列说法中正确的是( )
| A. | 向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| D. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 |
12.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如下:
(1)取实验2后的溶液,进行如图1实验:
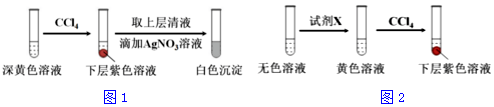
经检验,上述白色沉淀是AgCl.写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式:
ClO3-+6I-+6H+=Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图2实验,进一步佐证其中含有IO3-.其中试剂X可以是c(填字母序号).
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是进一步佐证4中生成了Cl2.
获得结论:NaClO3溶液用量增加导致溶液褪色原因是2ClO3-+I2=Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
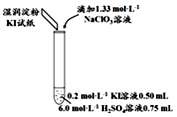 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式:
ClO3-+6I-+6H+=Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图2实验,进一步佐证其中含有IO3-.其中试剂X可以是c(填字母序号).
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是进一步佐证4中生成了Cl2.
获得结论:NaClO3溶液用量增加导致溶液褪色原因是2ClO3-+I2=Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O.
20.不能产生丁达尔效应的是( )
| A. | 豆浆 | B. | 淀粉溶液 | C. | Fe(OH)3胶体 | D. | 生理盐水 |
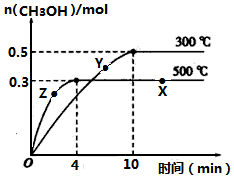 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.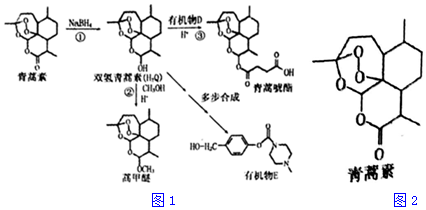
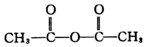 +H-OH→
+H-OH→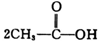
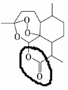 ;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.
;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.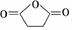 .
.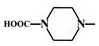 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式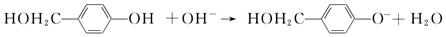 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.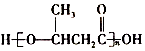 )的流程如图:
)的流程如图: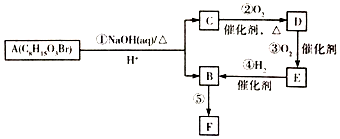
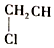 =
=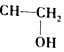
 .
.