题目内容
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:
(1)Y位于元素周期表第 周期第 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写最高价氧化物对应的水化物的化学式).
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式: ;
(3)XY2是一种常用的溶剂,XY2在空气中燃烧生成两种酸性氧化物,将此混合气体3.36L(标准状况)通入20mL 5mol/L NaOH溶液中,充分吸收后所得溶液中溶质的成分主要是 (填化学式).
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.
已知:
XO(g)+
O2(g)=XO2(g)△H=-283.0kJ?mol-2
Y(g)+O2(g)=YO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是 .(X、Y用实际的元素符号表示)
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式:
(3)XY2是一种常用的溶剂,XY2在空气中燃烧生成两种酸性氧化物,将此混合气体3.36L(标准状况)通入20mL 5mol/L NaOH溶液中,充分吸收后所得溶液中溶质的成分主要是
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.
已知:
XO(g)+
| 1 |
| 2 |
Y(g)+O2(g)=YO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四周期中的四种常见元素,X最外层电子数是次外层电子数的2倍,只能有2个电子层,最外层电子数为4,则X为C元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为S元素;Z和Y同周期,Z的非金属性大于Y,则Z为Cl;W的一种核素的质量数为23,中子数为12,质子数=23-12=11,则W为Na,据此解答.
解答:
解:X、Y、Z、W是元素周期表前四周期中的四种常见元素,X最外层电子数是次外层电子数的2倍,只能有2个电子层,最外层电子数为4,则X为C元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为S元素;Z和Y同周期,Z的非金属性大于Y,则Z为Cl;W的一种核素的质量数为23,中子数为12,质子数=23-12=11,则W为Na,
(1)Y为S元素,位于元素周期表第三周期第ⅥA族,非金属性S<Cl,故最高价氧化物对应的水化物的酸性较强的是HClO4,
故答案为:三;ⅥA;HClO4;
(2)Na元素生成的两种氧化物为Na2O、Na2O2,这两种氧化物的电子式分别为: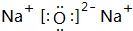 ,
,
故答案为: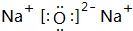 ;
; ;
;
(3)CS2是一种常用的溶剂,CS2在空气中燃烧生成两种酸性氧化物,反应生成二氧化碳、二氧化硫,将此混合气体3.36L(标准状况)的物质的量=
=0.15mol,故二氧化碳为0.15mol×
=0.05mol,二氧化硫为0.15mol-0.05mol=0.1mol,20mL 5mol/L NaOH溶液中n(NaOH)=0.02L×5mol/L=0.1mol,由于亚硫酸的酸性比较碳酸酸性强,故先是二氧化硫与氢氧化钠反应,二者物质的量之比为1:1,故恰好反应生成NaHSO3,即充分吸收后所得溶液中溶质的成分主要是NaHSO3,
故答案为:NaHSO3;
(4)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S,由电子转移守恒可知,还生成二氧化碳,反应方程式为:2CO+SO2=S↓+2CO2,
已知:①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ?mol-1
根据盖斯定律,①×2-②得:2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ/mol,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ/mol.
(1)Y为S元素,位于元素周期表第三周期第ⅥA族,非金属性S<Cl,故最高价氧化物对应的水化物的酸性较强的是HClO4,
故答案为:三;ⅥA;HClO4;
(2)Na元素生成的两种氧化物为Na2O、Na2O2,这两种氧化物的电子式分别为:
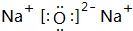 ,
,
故答案为:
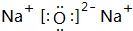 ;
; ;
;(3)CS2是一种常用的溶剂,CS2在空气中燃烧生成两种酸性氧化物,反应生成二氧化碳、二氧化硫,将此混合气体3.36L(标准状况)的物质的量=
| 3.36L |
| 22.4L/mol |
| 1 |
| 3 |
故答案为:NaHSO3;
(4)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S,由电子转移守恒可知,还生成二氧化碳,反应方程式为:2CO+SO2=S↓+2CO2,
已知:①CO(g)+
| 1 |
| 2 |
②S(g)+O2(g)=SO2(g)△H=-296.0kJ?mol-1
根据盖斯定律,①×2-②得:2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ/mol,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ/mol.
点评:本题考查结构性质位置关系应用,难度中等,(3)为易错点,注意根据酸性强弱判断反应进行的先后顺序问题.

练习册系列答案
相关题目
下列有关化学用语正确的是( )
A、HCl的电子式为 | ||
B、Cl-的结构示意图  | ||
C、氮气的电子式  | ||
D、质量数为37的氯原子
|
胶体区别于其他分散系的本质特征是( )
| A、有丁达尔现象 |
| B、有聚沉现象 |
| C、可以无规则的运动 |
| D、分散质粒子直径在1-100nm |
关于下列各装置图的叙述中,正确的是( )
A、 制取及观察Fe(OH)2 |
B、 比较两种物质的稳定性 |
C、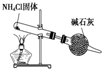 实验室制取NH3 |
D、 分离沸点不同且互溶的液体混合物 |
下列说法正确的是( )
| A、230Th和232Th是钍的两种同素异形体 |
| B、H2与T2互为同位素 |
| C、甲醇与乙二醇互为同系物 |
| D、乙酸乙酯与丁酸互为同分异构体 |
下列反应的离子方程式正确的是( )
| A、NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
| B、碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ |
| C、FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O |
| D、Na2CO3发生水解反应:CO32-+2H2O═H2CO3+2OH- |