题目内容
300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)═2C(g)+2D(g)△H=Q,2min末达到平衡,生成0.8mol D.
(1)在2min末时,B的平衡浓度为 ,A的平均反应速率为 .
(2)若温度不变,缩小容器容积,则平衡 (填“向正反应方向移动”、“向逆反应方向移动”或“不移动”).
(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体中c(C)不变
C.υ生成(D)=υ消耗(D)
D.2c(B)=c(C)
(1)在2min末时,B的平衡浓度为
(2)若温度不变,缩小容器容积,则平衡
(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体中c(C)不变
C.υ生成(D)=υ消耗(D)
D.2c(B)=c(C)
考点:化学平衡状态的判断,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据生成D的物质的量,计算参加反应的A、B的物质的量,进而计算平衡时B的物质的量,根据c=
计算B的平衡浓度,根据速率之比等于对应物质的化学计量数之比;
(2)若温度不变,缩小容器容积,相当于增大压强,两边的化学计量数相等,平衡不移动;
(3)根据选项判断正、逆反应速率是否相等;
| n |
| V |
(2)若温度不变,缩小容器容积,相当于增大压强,两边的化学计量数相等,平衡不移动;
(3)根据选项判断正、逆反应速率是否相等;
解答:
解:(1)2min末反应达到平衡状态,生成0.8molD,则参加反应的A、B的物质的量都是0.8mol,
平衡时B的物质的量=2mol-0.8mol=1.6mol,故B的平衡浓度=
=0.8mol/L,v(D)=
=0.2mol/(L?min),而v(A)=
v(D)=0.3 mol/(L?min),故答案为:0.8mol/L;0.3 mol/(L?min);
(2)若温度不变,缩小容器容积,相当于增大压强,两边的化学计量数相等,平衡不移动,故答案为:不移动;
(3)A.容器中压强不变,未平衡时就不变,故不选;
B.混合气体中c(C)不变,说明C正、逆反应速率相等,故选;
C.υ生成(D)=υ消耗(D),说明D正、逆反应速率相等,故选;
D.2c(B)=c(C),可能平衡,也可能未平衡,与起始量,和转化率有关,故不选;
故答案为:BC.
平衡时B的物质的量=2mol-0.8mol=1.6mol,故B的平衡浓度=
| 1.6mol |
| 2L |
| ||
| 2min |
| 3 |
| 2 |
(2)若温度不变,缩小容器容积,相当于增大压强,两边的化学计量数相等,平衡不移动,故答案为:不移动;
(3)A.容器中压强不变,未平衡时就不变,故不选;
B.混合气体中c(C)不变,说明C正、逆反应速率相等,故选;
C.υ生成(D)=υ消耗(D),说明D正、逆反应速率相等,故选;
D.2c(B)=c(C),可能平衡,也可能未平衡,与起始量,和转化率有关,故不选;
故答案为:BC.
点评:本题考查化学平衡计算、平衡状态的判断等,难度中等.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
可用来鉴别苯酚溶液、乙酸乙酯、乙苯、庚烯的一组试剂是( )
| A、银氨溶液、溴水 |
| B、酸性高锰酸钾溶液、氯化铁溶液 |
| C、酸性高锰酸钾溶液、溴水 |
| D、氯化铁溶液、溴水 |
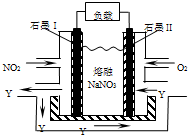 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )| A、石墨I附近发生的反应为NO2+NO3--e-═N2O5 |
| B、石墨Ⅱ附近反生的反应为O2-4e-═2O2- |
| C、该电池放电时NO3-从右侧向左侧迁移 |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种.请回答下列问题: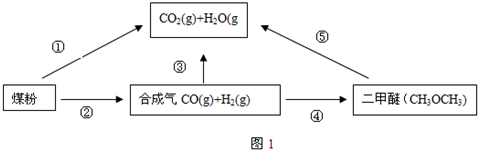
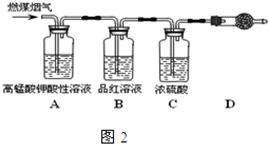
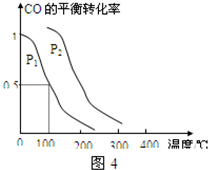
 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: