题目内容
8.氧化还原是一类重要的反应.(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+,②Cu2++Fe=Cu+Fe2+
反应①中还原剂是Cu,两个反应中各种离子的氧化性从强到弱的顺序是Fe3+>Cu2+>Fe2+.
(2)在反应MnO2+4HCI$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是2.24L.
(3)已知反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
①铜与稀硝酸反应的离子方程式是3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O.
②下列物质中,放到铜粉和稀硫酸中,能实现铜粉溶解的是AC.
A.KNO3 B.K2SO4 C.Cu(NO3)2.
分析 (1)存在元素的化合价降低的物质为还原剂;氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
(2)反应中化合价升高的Cl元素失2个电子,化合价降低的Mn元素得到2个电子;
(3)①铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
②放到铜粉和稀硫酸中,能实现铜粉溶解,所加物质在酸性条件下应具有强氧化性.
解答 解:(1)已知:①Cu+2Fe3+=Cu2++2Fe2+,Cu元素的化合价升高,则Cu为还原剂;氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则①中氧化性:Fe3+>Cu2+,②中氧化性:Cu2+>Fe2+,所以氧化性从强到弱的顺序是Fe3+>Cu2+>Fe2+;
故答案为:Cu;Fe3+>Cu2+>Fe2+;
(2)在反应MnO2+4HCI$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O中,当生成1mol氯气时转移2mol电子,则有0.2mol电子转移时,产生氯气为0.1mol,其体积(标准状况)是2.24L;
故答案为:2.24L;
(3)①铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O;
②放到铜粉和稀硫酸中,能实现铜粉溶解,所加物质在酸性条件下应具有强氧化性,题中KNO3和Cu(NO3)2符合,
故答案为:AC.
点评 本题考查氧化还原反应,侧重于概念的理解和计算,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.

练习册系列答案
相关题目
18.实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置.
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是A(写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是C(写编号),写出微热时的反应方程式NaCl+H2SO4 $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气.
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目.
②反应中Cl元素被氧化,KMnO4是氧化剂.当有1mol电子转移时,可生成气体11.2升(标准状态下).
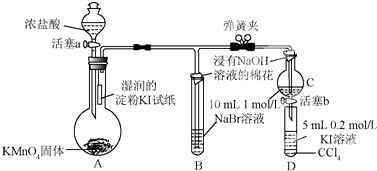
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:
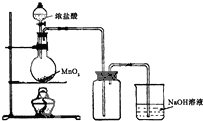
①写出圆底烧瓶中发生反应的化学方程式_MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
| 编号 | A | B | C |
发 生 装 置 | 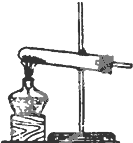 |  | 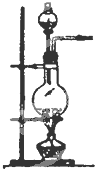 |
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是C(写编号),写出微热时的反应方程式NaCl+H2SO4 $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气.
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目.
②反应中Cl元素被氧化,KMnO4是氧化剂.当有1mol电子转移时,可生成气体11.2升(标准状态下).
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:

①写出圆底烧瓶中发生反应的化学方程式_MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
19.生活中遇到的某些问题,常常涉及化学知识,下列各项分析不正确的是( )
| A. | “绿色食品”“白色污染”“赤潮”都不仅仅与颜色有关 | |
| B. | 苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 | |
| C. | “酸可以除锈”“洗涤剂可以去油”都是发生了化学变化 | |
| D. | 区分植物油和矿物油的方法是加入足量的烧碱溶液共煮,不再分层的为植物油 |
3.在Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2的中,下列叙述正确的是( )
| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
13.在标准状况下进行下列实验:甲、乙、丙各取30.00mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
(1)分析上表数据后填空:
①盐酸的物质的量浓度为1mol/L,在表中可作为计算依据的是(填实验序号,要求全部写出)乙、丙
②据(填实验序号)甲中的数据,可计算出合金中镁与铝的物质的量之比为1:1
(2)在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体请计算:
①滤液中溶质的物质的量
②加入NaOH溶液的体积.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
①盐酸的物质的量浓度为1mol/L,在表中可作为计算依据的是(填实验序号,要求全部写出)乙、丙
②据(填实验序号)甲中的数据,可计算出合金中镁与铝的物质的量之比为1:1
(2)在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体请计算:
①滤液中溶质的物质的量
②加入NaOH溶液的体积.
20.下列各组混合物中能用分液漏斗进行分离的是( )
| A. | 酒精和水 | B. | 汽油和植物油 | C. | 水和四氯化碳 | D. | 碘和四氯化碳 |
 .
.