题目内容
2.请配平新型高效净水剂的制备化学方程式(将系数填在横线上):2KClO3+4HCl(浓)--2KCl+2ClO2↑+1Cl2↑+2H2O
该反应中被氧化的氯元素与被还原的氯元素的质量之比是1:1.
分析 反应中KClO3中的+5价的氯化合价降为ClO2中+4价的氯,HCl中-1价的氯化合价升高为Cl2中0价的氯,生成1molClO2,得到2mol电子,生成1molCl2,失去2mol电子守恒,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
依据方程式结合氧化还原反应中所含元素化合价降低的被还原,所含元素化合价升高的被氧化解答.
解答 解:反应中KClO3中的+5价的氯化合价降为ClO2中+4价的氯,HCl中-1价的氯化合价升高为Cl2中0价的氯,生成1molClO2,得到2mol电子,生成1molCl2,失去2mol电子守恒,依据氧化还原反应得失电子守恒可知:ClO2系数为2,Cl2系数为1,则KClO3系数为2,依据原子个数守恒可知:KCl系数为2,HCl系数为4,H2O系数为2,方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+1Cl2↑+2H2O;
依据方程式:2KClO3+4HCl(浓)=2KCl+2ClO2↑+1Cl2↑+2H2O,反应中2molKClO3中+5价的氯化合价降低,则被还原的氯原子为2mol;反应中4molHCl只有2mol-1价的氯化合价升高被氧化,所以被氧化的氯原子为2mol,则被氧化的氯元素与被还原的氯元素的质量之比是1:1;
故答案为:2;4;2;2;1;2;1:1;
点评 本题考查了氧化还原反应方程式配平及基本概念判断,准确判断方程式中各元素化合价变化,明确氧化还原反应得失电子守恒、原子个数守恒规律是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )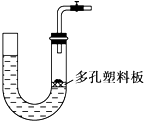

| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制取氧气 |
10.某溶液中含有Fe3+、Fe2+、Al3+、NH4+离子的稀溶液.向其中加入足量的Na2O2固体后,充分反应,再加入过量稀盐酸,溶液中离子数目没有变化的是( )
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、NH4+ | D. | Fe3+ |
7.下列有关物质用途的叙述错误的是( )
| A. | 硫磺有杀虫、杀螨、杀菌作用 | |
| B. | 石膏可以用做雕像材料 | |
| C. | 碳酸钡常用于治疗胃病,俗称“钡餐” | |
| D. | 明矾可做净水剂 |
12.下面的原子或原子团不属于官能团的是( )
| A. | NO3- | B. | -NO2 | C. | -OH | D. | -COOH |
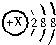
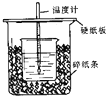 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.