题目内容
16.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.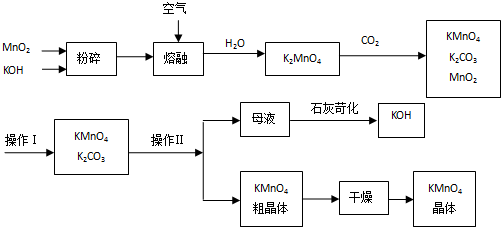
①KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是ad(填代号).
a.84消毒液(NaClO溶液) b.75%酒精 c.苯酚 d.双氧水
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是b(填代号).
a.浓硝酸 b.烧碱 c.氯水 d.硝酸银
③上述流程中可以循环使用的物质有MnO2、KOH等(写化学式,一种即可).
④该生产中需要纯净的CO2气体.若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)cd .
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱溶液
⑤操作Ⅱ,根据KMnO4和K2CO3两物质在固体物质的溶解度上的差异,可采用蒸发浓缩(填操作步骤)、趁热过滤得到KMnO4粗晶体.
分析 将MnO2和KOH粉碎,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用加热浓缩、冷却结晶的方法获得KMnO4晶体,母液中含有K2CO3,加入CaO,发生反应K2CO3+CaO+H2O=CaCO3↓+2KOH,从而得到KOH,将KMnO4晶体洗涤干燥得到纯净的KMnO4晶体,
①高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒;
②见光易分解的物质常常保存在棕色试剂瓶中;
③最初反应物中和最终生成物中含有的物质就能循环利用;
④根据反应物和生成物的特点选取药品,盐酸有挥发性,硫酸钙是微溶物;
⑤分离易溶于水的两种溶质根据其溶解度差异性采用蒸发结晶方法
解答 解:将MnO2和KOH粉碎,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用加热浓缩、冷却结晶的方法获得KMnO4晶体,母液中含有K2CO3,加入CaO,发生反应K2CO3+CaO+H2O=CaCO3↓+2KOH,从而得到KOH,将KMnO4晶体洗涤干燥得到纯净的KMnO4晶体,
①高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒.
a、次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故正确;
b、酒精是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;
c、苯酚是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;
d、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故正确;
故选ad;
②见光易分解的物质常常保存在棕色试剂瓶中.
a.浓硝酸见光分解生成二氧化氮、氧气和水,所以要保存在棕色试剂瓶中,故不选;
b.烧碱见光不分解,所以不要保存在棕色试剂瓶中,故选;
c.氯水中的次氯酸见光分解生成盐酸和氧气,所以要保存在棕色试剂瓶中,故不选;
d.硝酸银见光分解生成银、二氧化氮和氧气,所以要保存在棕色试剂瓶中,故不选;
故选b;
③在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用,故答案为:MnO2、KOH;
④石灰石和酸反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢导致气体不纯,则不能选用盐酸和石灰石;
稀硫酸和碳酸钙反应生成微溶的硫酸钙阻止进一步的反应,则不能选用石灰石和硫酸;
而稀硫酸和纯碱反应生成二氧化碳,稀硫酸没有挥发性,硫酸钠是可溶性的物质,所以可以制取较纯净的二氧化碳,则选用稀硫酸和纯碱;
故选cd;
⑤操作II是将两种可溶于性盐分离开,应该是利用物质溶解度的差异,通过蒸发浓缩、趁热过滤的方式将二者分离开.
故答案为:蒸发浓缩.
点评 本题考查了制备实验中的有关知识,难度不大,明确常用消毒剂的消毒原理、化学试剂的存放等知识点,易错题是④,注意不同反应物对所制得的气体的影响.

| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
| A. | 吗啡、海洛因等虽然有麻醉、止痛、镇静作用,但易上瘾且有害,这类物质属于毒品 | |
| B. | 大量使用纯碱可使钙离子沉淀完全,预防胆结石产生 | |
| C. | 为使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| D. | 碳酸氢钠可作为抗酸药,阿司匹林是重要的抗生素 |
| A. | MgCl2=Mg2++2Cl- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | NaHCO3=Na++H++CO32- | D. | NaOH=Na++OH- |
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、NH4+ | D. | Fe3+ |
 如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题: 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.