题目内容
17.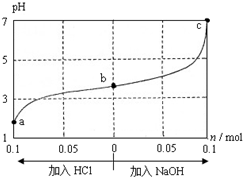 25℃时,将1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )
25℃时,将1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | a、b、c三点都有c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
分析 1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加盐酸时,CH3COONa与盐酸反应生成CH3COOH;加NaOH时,NaOH与CH3COOH反应生成CH3COONa,
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小;
B.c点pH=7,根据电荷守恒分析;
C.a点溶液中不存在钠离子;
D.pH=7时,c(H+)=10-7mol•L-1,根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算.
解答 解:1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加盐酸时,CH3COONa与盐酸反应生成CH3COOH;加NaOH时,NaOH与CH3COOH反应生成CH3COONa;
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,故A错误;
B.c点pH=7,则c(H+)=c(OH-),溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)=c(CH3COO-),故B错误;
C.根据电荷守恒,b、c点都满足c(CH3COO-)+c(OH-)=c(Na+)c(H+),而a点溶液为醋酸溶液,根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(H+),故C错误;
D.pH=7时,c(H+)=10-7mol•L-1,c(Na+)=c(CH3COO-)=0.2mol/L,则醋酸的电离平衡常数为:Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.2}{w-0.2}$×10-7mol•L-1,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及弱电解质的电离、电离常数的计算、溶液中守恒关系的应用等,注意把握电离常数的计算和电荷守恒的应用,侧重于考查学生的分析能力和对基础知识的应用能力、计算能力.

| A. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O; ③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu; ④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有$\stackrel{+1}{Cu}$:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是沉淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为$\stackrel{+1}{Cu}$.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.
根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
| A. | 明矾可用于净水 | |
| B. | 氨可用于生产铵盐、纯碱 | |
| C. | 铝热反应可用于冶炼某些金属 | |
| D. | 核磁共振氢谱可用于测量某些有机物的相对分子质量 |
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是硫酸铜与锌反应生成铜,形成铜、锌、稀硫酸原电池,加快化学反应速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,
适当增加硫酸的浓度或增加锌粒的表面积等(答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实 验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
 香叶醇是合成玫瑰精油的主要原料,其结构简式如下:
香叶醇是合成玫瑰精油的主要原料,其结构简式如下: 中,在同一平面上的碳原子最少有9个,最多有14个.
中,在同一平面上的碳原子最少有9个,最多有14个.