题目内容
19.工业上可用以下方案使饮用水中NO3-含量达标.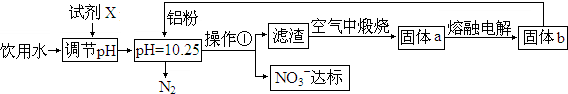
请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成铝的利用率降低;试剂X可选用B(填序号).
A.KOH B.Ca(OH)2 C.CO2 D.CuO
(2)流程中操作①的名称为过滤,若在实验室中进行此操作,所需要的玻璃仪器是烧杯、漏斗、玻璃棒.
(3)写出溶液中铝粉和NO3-反应的离子方程式:10Al+6NO3-+18H2O═10Al(OH)3↓+3N2↑+6OH-.
(4)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分.完成下列离子方程式:5H2+2NO3-+2H+ $\frac{\underline{\;催化剂\;}}{\;}$N2+6H2O.
分析 试剂X为Ca(OH)2,选用Ca(OH)2调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,在pH=10.25时加入铝粉,与NO3-发生氧化还原反应生成氮气和氢氧化铝,煅烧生成氧化铝,电解可生成铝,以此解答该题.
解答 解:试剂X为Ca(OH)2,选用Ca(OH)2调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,在pH=10.25时加入铝粉,与NO3-发生氧化还原反应生成氮气和氢氧化铝,煅烧生成氧化铝,电解可生成铝,
(1)选用熟石灰调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,注意pH过大或过小,都将直接发生Al与酸或碱的反应,否则会造成Al的大量消耗,
故答案为:铝;B;
(2)流程中操作①用于分离固体和液体,为过滤操作,用到的仪器有烧杯、漏斗、玻璃棒,故答案为:过滤; 烧杯、漏斗、玻璃棒;
(3)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3-反应的离子方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-,
故答案为:10Al+6NO3-+18H2O═10Al(OH)3↓+3N2↑+6OH-;
(4)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-+2H+$\frac{\underline{\;催化剂\;}}{\;}$N2+6H2O,
故答案为:5;2;2H+;N2;6.
点评 本题以信息的形式考查氧化还原反应、离子反应,侧重于学生的分析、实验能力的考查,为高频考点和常见题型,注重对化学用语的考查,注意知识与题目信息的结合来解答,对学生能力要求较高,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
9.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3ˉ、NO3ˉ、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
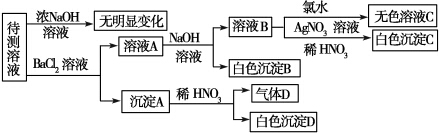
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
(2)待测溶液中是否有SO42-、SO32-中的一种或两种.若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,形成沉淀B时反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O.
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
7.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |
14.将铁片投入下列溶液中,溶液质量变大的是( )
| A. | 硝酸银 | B. | 硫酸铁 | C. | 硫酸铜 | D. | 氯化镁 |
11.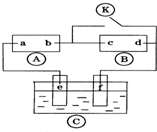 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )
 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通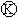 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
8.下列关于物质分类的说法正确的是( )
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
 +Cl2
+Cl2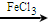
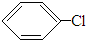 +HCl,反应类型取代反应.
+HCl,反应类型取代反应.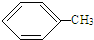 +3HO-NO2
+3HO-NO2
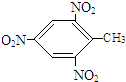 +3H2O,反应类型取代反应.
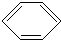
+3H2O,反应类型取代反应. +3H2
+3H2
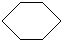 ,反应类型加成反应.
,反应类型加成反应. +Br2
+Br2
 +HBr,反应类型取代.
+HBr,反应类型取代.