题目内容
下列离子方程式书写正确的是( )
| A、水壶中水垢用食醋除去:2H++CaCO3=Ca2++CO2↑+H2O 2H++Mg(OH)2=Mg2++2H2O |
| B、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、向FeI2溶液中通入少量Cl2 2I-+Cl2=I2+2Cl- |
| D、等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3↑+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、醋酸为弱酸,应写成化学式;
B、硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,说明氢离子浓度与氢氧根离子浓度相等,都为1mol,同时溶液中1mol的硫酸根离子和0.5mol钡离子,硫酸根离子过量;
C、通入少量Cl2,还原性强的微粒反应;
D、没加热应生成一水合氨.
B、硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,说明氢离子浓度与氢氧根离子浓度相等,都为1mol,同时溶液中1mol的硫酸根离子和0.5mol钡离子,硫酸根离子过量;
C、通入少量Cl2,还原性强的微粒反应;
D、没加热应生成一水合氨.
解答:
解:A、醋酸为弱酸,应写成化学式,正确的离子方程式为2CH3COOH+CaCO3=Ca2++CO2↑+2CH3COO-+H2O 2CH3COOH+Mg(OH)2=Mg2++2H2O+2CH3COO-,故A错误;
B、硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,说明氢离子浓度与氢氧根离子浓度相等,都为1mol,同时溶液中1mol的硫酸根离子和0.5mol钡离子,硫酸根离子过量,正确的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C、通入少量Cl2,还原性强的微粒反应,离子方程式为2I-+Cl2=I2+2Cl-,故C正确;
D、没加热应用一水合氨,正确的离子方程式为Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O,故D错误;
故选C.
B、硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,说明氢离子浓度与氢氧根离子浓度相等,都为1mol,同时溶液中1mol的硫酸根离子和0.5mol钡离子,硫酸根离子过量,正确的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C、通入少量Cl2,还原性强的微粒反应,离子方程式为2I-+Cl2=I2+2Cl-,故C正确;
D、没加热应用一水合氨,正确的离子方程式为Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O,故D错误;
故选C.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |  |
FeCl2 | FeCl3 | Fe | CuCl2 |
| ② | Mg | MgO | MgCl2 | Mg(OH)2 | |
| ③ | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A、①④ | B、②④ |
| C、①③④ | D、①②③ |
食用下列食品,通常不会对人体造成危害的是( )
| A、用甲醛溶液浸泡的海鲜品 |
| B、牛奶经工业发酵后得到的酸奶 |
| C、加有苏丹红Ⅰ号调色剂的鲜辣酱 |
| D、二氧化硫熏制后的白面粉? |
下列有关叙述不正确的是( )
| A、铝热反应是炼铁最常用的方法 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、Na2FeO4有强氧化性,可用作自来水的消毒剂 |
| D、小苏打和氢氧化铝均可用来作治疗胃酸过多的药物 |
下列表示对应化学反应的离子方程式正确的是( )
| A、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
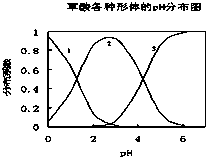 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: