题目内容
10.已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③C+D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
(1)写出下列符号对应的化学式:ABaCl2、BFeSO4;
(2)实验②中沉淀由白色沉淀转化为红褐色发生反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)现象③中白色沉淀消失所发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 由③C+D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失,可知白色沉淀为氢氧化铝,D为NaOH,C为AlCl3,再结合②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色可知,B为FeSO4,最后结合①可知A为BaCl2,以此来解答.
解答 解:A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,
能相互反应生成沉淀的有:AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,现象为先生成白色沉淀,后沉淀溶解;
BaCl2+FeSO4═BaSO4↓+2NaCl,现象为出现不溶于酸的白色沉淀;
FeSO4+2NaOH═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,特征现象为出现白色沉淀,立即变为红褐色.
由③C+D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失,可知白色沉淀为氢氧化铝,D为NaOH,C为AlCl3,再结合②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色可知,B为FeSO4,最后结合①可知A为BaCl2,
(1)由上述分析可知,A为BaCl2,B为,故答案为:BaCl2;FeSO4;
(2)②中沉淀由白色沉淀转化为红褐色发生反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)现象③中白色沉淀消失所发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查无机物的推断,为高频考点,把握氢氧化铝的两性,红褐色沉淀为氢氧化铁为解答的关键,侧重分析与推断能力的考查,题目难度不大.

 全优点练单元计划系列答案
全优点练单元计划系列答案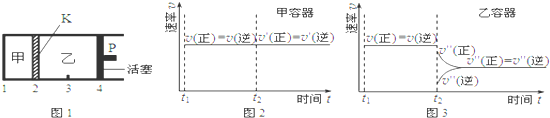
| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
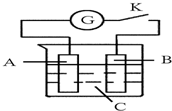 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )| A. | A是Cu、B是Zn、C是CuSO4溶液 | B. | A是Cu、B是Cu、C是H2SO4溶液 | ||
| C. | A是Zn、B是石墨、C是稀H2SO4溶液 | D. | A是石墨、B是Zn、C是CuSO4溶液 |

下列有关说法不正确的是( )
| A. | 由Ⅱ可知X中一定存在SiO2 | B. | 无法判断混合物中是否含有Na2O | ||
| C. | 1.92 g固体成分为Cu | D. | 15.6 g混合物X中m(Fe2O3):m(Cu)=1:1 |
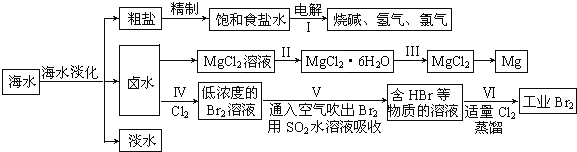
(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).
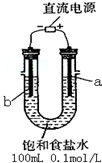
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质. .
.
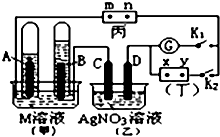 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
