题目内容
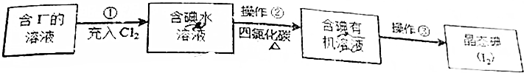
5. 非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.
非金属单质A和金属单质M可发生如图所示的转化关系,L的焰色是黄色,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀.请回答以下问题:
(1)写出K的化学式:Na2S.
(2)写出C与水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑
(3)写出D与N反应的离子方程式:SO2+2OH-=SO32-+H2O.
分析 L的焰色是黄色,则L中含有Na元素,金属单质M与氧气连续反应生成C,C与水反应生成D,而D与J反应得到L,则A为Na,非金属单质A与氧气连续反应生成I,I与水反应生成J,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀,则L含有硫酸根,故L为Na2SO4,由转化关系,可知B为Na2O、C为Na2O2、D为NaOH、M为S、N为SO2、I为SO3、J为H2SO4、K为Na2S.
解答 解:L的焰色是黄色,则L中含有Na元素,金属单质M与氧气连续反应生成C,C与水反应生成D,而D与J反应得到L,则A为Na,非金属单质A与氧气连续反应生成I,I与水反应生成J,往L的溶液中加入稀盐酸和BaCl2溶液会生成白色沉淀,则L含有硫酸根,故L为Na2SO4,由转化关系,可知B为Na2O、C为Na2O2、D为NaOH、M为S、N为SO2、I为SO3、J为H2SO4、K为Na2S.
(1)K的化学式:Na2S,故答案为:Na2S;
(2)C与水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)D与N反应的离子方程式:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O.
点评 本题考查无机物推断,涉及Na、S元素单质化合物性质,焰色反应及产生白色沉淀为推断突破口,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.工业合成氨是人工固氮方法之一.

I.已知下列物质的键能:
则N2(g)+3H2(g)?2nh3(g)△H=-92kJ/mol
Ⅱ恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如图1.
(1)图1中0~2s内的反应速率v(H2)=0.75mol/(L.s);该温度下平衡常数的计算表达式为$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$.
(2)该反应达到平衡的标志为AD(填序号).
A.混合气体的平均相对分子质量不变
B.物质的量浓度比等于系数比
C.容器内温度不变
D.断裂1moIH-H键同时断裂2molN-H键
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)增大(填“增大”、“减小”、“不变’’或“不能确定”).
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.
若用 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.

I.已知下列物质的键能:
| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
Ⅱ恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如图1.
(1)图1中0~2s内的反应速率v(H2)=0.75mol/(L.s);该温度下平衡常数的计算表达式为$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$.
(2)该反应达到平衡的标志为AD(填序号).
A.混合气体的平均相对分子质量不变
B.物质的量浓度比等于系数比
C.容器内温度不变
D.断裂1moIH-H键同时断裂2molN-H键
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)增大(填“增大”、“减小”、“不变’’或“不能确定”).
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.
若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
13.在合成氨反应中:N2+3H2?2NH3经过一段时间,NH3的浓度增加了0.6mol/L,在此段时间内用V(H2)表示反应速率为V(H2)=0.45mol/(L•S),则这段时间为( )
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
20.下列离子组中一定能够大量共存的是( )
| A. | 无色溶液中:Na+、Cl-、SCN-、Fe3+ | |
| B. | 碱性溶液中:Na+、AlO2-、Cl-、SO42- | |
| C. | 加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ | |
| D. | 无色溶液中:Na+、HCO3-、Cl-、OH- |
17.下列说法正确的是( )
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. | 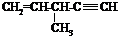 催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
14.现有盐酸、BaC12溶液、HClO溶液和饱和的澄清石灰水,可用一种试剂将它们直接鉴别,该试剂是( )
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
15.已知在0.1mol•L-1的CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
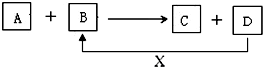 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白: