题目内容
5.化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.某化学兴趣小组对氯及其化合物进行探究.(1)漂白精广泛用于饮用水消毒、医院环境消毒、游泳池消毒.资料查阅:随漂白精溶液酸性的增强,溶液会变为黄绿色.出现该现象的原因为Cl0-+Cl-+2H+=Cl2+H2O(用离子方程式表示).
(2)实验室可用氯气与金属铁反应制备无水三氯化铁.三氯化铁呈棕红色、易潮解,100℃左右时升华.某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁.
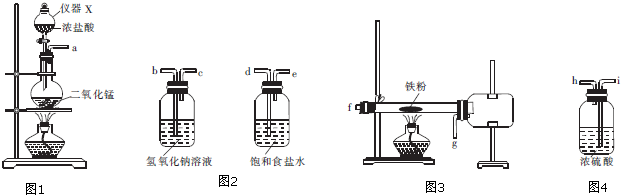
①仪器X的名称为分液漏斗.
②制备三氯化铁的反应开始前,需排除装置中的空气,采取的方法是制备氯气的反应进行一段时间候,看到黄绿色气体充满装置,再开始加热硬质玻璃管.
③实验装置的连接顺序是a→d→e→i→h→f→g→i→h→b.
(3)设计实验证明FeC13的氧化性比I2强:在淀粉碘化钾溶液中加入氯化铁,溶液变蓝说明氯化铁氧化性强于碘.
分析 (1)次氯酸根离子具有强的氧化性能够氧化氯离子生成氯气;
(2)①熟悉仪器构造,说出其名称;
②利用生成的氯气排出装置中的空气;
③制备无水三氯化铁装置连接顺序:制备氯气、除去氯化氢、干燥氯气、制备氯化铁、防止尾气处理装置中水蒸气进入硬质试管、尾气处理装置,据此解答;
(3)氯化铁氧化性若强于碘,则依据氧化性强弱规律可知,氯化铁能够氧化碘离子生成单质碘,碘遇到淀粉变蓝,据此设计实验.
解答 解:(1)次氯酸根离子具有强的氧化性能够氧化氯离子生成氯气,离子方程式:Cl0-+Cl-+2H+=Cl2+H2O,故答案为:Cl0-+Cl-+2H+=Cl2+H2O;
(2)①X是分液漏斗,故答案为:分液漏斗;
②硬质试管中的反应开始前,需排除装置中的空气,防止氧气和铁反应生成铁的氧化物而产生杂质,所以硬质试管中的反应开始前,必须排除装置中的空气,其方法是制备氯气的反应进行一段时间后,看到共绿色气体充满装置,再开始加热硬质试管,
故答案为:制备氯气的反应进行一段时间后,看到共绿色气体充满装置,再开始加热硬质试管;
③制备无水三氯化铁装置连接顺序:制备氯气、除去氯化氢、干燥氯气、制备氯化铁、防止尾气处理装置中水蒸气进入硬质试管、尾气处理装置,洗气是应长进短出,所以正确的顺序为:a→d→e→i→h→f→g→i→h→b;
故答案为:d→e→i→h→f→g→i→h→b;
(3)氯化铁氧化性若强于碘,则依据氧化性强弱规律可知,氯化铁能够氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以要证明FeC13的氧化性比I2强,可以:在淀粉碘化钾溶液中加入氯化铁,溶液变蓝说明氯化铁氧化性强于碘;
故答案为:在淀粉碘化钾溶液中加入氯化铁,溶液变蓝说明氯化铁氧化性强于碘.
点评 本题以氯化铁的制备为载体,考查了氯气的制备和净化、性质的检验,明确氯气制备原理和氯气的氧化性是解题关键,题目难度不大.

| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
| A. | 原子半径:W>Y>X | |
| B. | 元素X与M形成的化合物的空间构型可能是正四面体、直线型或平面型 | |
| C. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| D. | 由Z、M两种种元素形成的化合物一定只有极性共价键 |

| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
| A. | 胶体粒子带电荷并且在一定条件下能稳定存在Ba2+,Cu2+,Ag+溶液沉淀1溶液沉淀3+C+B+A沉淀2 | |
| B. | 胶体的分散质粒子直径在1 nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
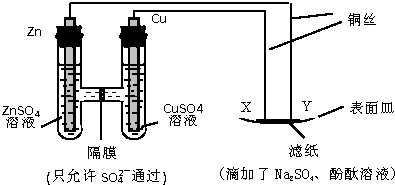
| A. | Y 与滤纸接触处有氧气生成 | B. | X 为正极,发生氧化反应 | ||
| C. | Y 为阴极,发生还原反应 | D. | X 与滤纸接触处变红 |
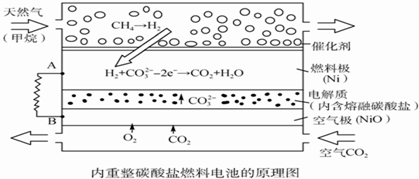
| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
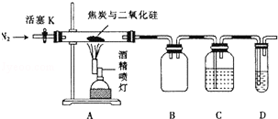 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.
某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.