题目内容
13.下列物质:①Na ②H2O ③酒精 ④CO2 ⑤NH3 ⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸) ⑨蔗糖 ⑩NaCl溶液•BaSO4.属于电解质的是②⑥⑦⑧⑪,属于非电解质的是③④⑤⑨.(填序号)
分析 在水溶液或者熔融状态下能够导电的化合物是电解质;在水溶液和熔融状态下都不能导电的化合物是非电解质;据此分析.
解答 解::①Na是单质,既不是电解质也不是非电解质;
②H2O是电解质;
③酒精在水溶液中和熔融状态下均不能导电,故为非电解质;
④CO2 在水溶液中和熔融状态下均不能导电,故为非电解质;
⑤NH3 在水溶液中和熔融状态下均不能导电,故为非电解质;
⑥Cu(OH)2在熔融状态下能导电,故为电解质;
⑦Ba(OH)2 在水溶液中和熔融状态下均能导电,故为电解质;
⑧冰醋酸(纯净的醋酸)在水溶液中能导电,故为电解质;
⑨蔗糖在水溶液中和熔融状态下均不能导电,故为非电解质;
⑩NaCl溶液是混合物,故既不是电解质也不是非电解质;
⑪BaSO4在熔融状态下能导电,故为电解质.
故答案为::②⑥⑦⑧⑪;③④⑤⑨.
点评 本题考查电解质与非电解质,解答该类概念性题目,应对概念十分清晰.抓住概念中的关键词,并注意大多数有机化合物都是非电解质,强电解质必须能完全电离,题目难度不大.

练习册系列答案
相关题目
1.下列有关物质的性质与其应用不相对应的是( )
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | KAl(SO4)2水解可生成Al(OH)3胶体,可用于自来水的净化 | |
| C. | NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 |
3.如图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系.该溶液的成分可能是 a( )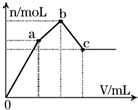

| A. | Na2SO4与NaAlO2组成的混合物 | B. | KAl(SO4)2 | ||
| C. | Al2(SO4)3 | D. | NH4Al(SO4)2 |



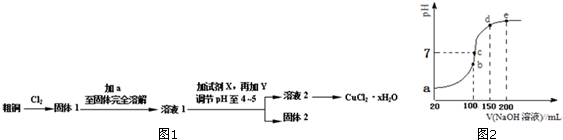
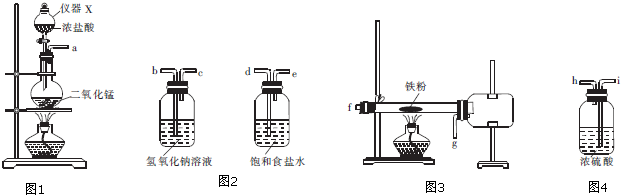
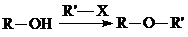 ②
②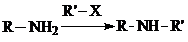
 试剂W
试剂W .
.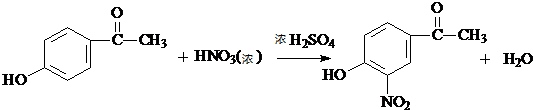 .
.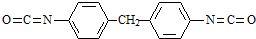 生成高聚物的结构简式
生成高聚物的结构简式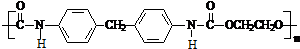 .
.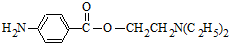 (无机试剂任用)(合成路线表示方式为:反应试剂A反应条件B…反应试剂反应条件目标产物)
(无机试剂任用)(合成路线表示方式为:反应试剂A反应条件B…反应试剂反应条件目标产物)