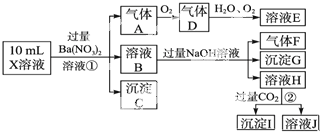
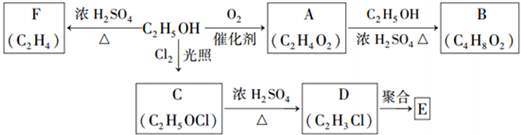
题目内容
4. (1)指出下列能量的变化:
(1)指出下列能量的变化:学校燃烧煤煮饭化学能转化为热能,用畜电池点亮灯泡电能转化为光能.
(2)原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
①a和b不连接时,烧杯中现象是若锌片逐渐溶解,锌片上有气泡冒出.
②a和b用导线连接,Cu极为原电池正极(填“正”或“负”),电极反应式为:2H++2e-=H2↑;溶液中H+移向Cu(填“Cu”或“Zn”)极.电池总反应式为:Zn+H2SO4=ZnSO4+H2↑.
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为21.6g.
分析 (1)燃烧是将化学能转化为热能,畜电池点亮灯泡是电能转化为光能;
(2)①a和b不连接时,不能构成原电池,锌片与稀硫酸反应产生氢气,铜不与稀硫酸反应;
②a和b用导线连接时,该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn-2e-=Zn2+、正极反应为2H++2e-=H2↑,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
③根据银和转移电子之间的关系式计算.
解答 解:(1)燃烧是将化学能转化为热能,畜电池点亮灯泡是电能转化为光能,
故答案为:化学能转化为热能;电能转化为光能;
(2)①a和b不连接时,不能构成原电池,锌片与稀硫酸反应产生氢气,铜不与稀硫酸反应,则烧杯中现象是锌片逐渐溶解,锌片上有气泡冒出,
故答案为:锌片逐渐溶解,锌片上有气泡冒出;
②a和b用导线连接时,该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为2H++2e-=H2↑,电池总反应式为:Zn+H2SO4=ZnSO4+H2↑,
故答案为:正; 2H++2e-=H2↑; Cu;Zn+H2SO4=ZnSO4+H2↑;
③银离子在正极铜上得电子:Ag++e-=Ag,当转移电子物质的量为0.2mol,其正极析出银的质量为0.2mol×108g/mol=21.6g,
故答案为:21.6.
点评 本题考查原电池原理、氧化还原反应的有关计算等知识点,明确原电池电极反应式的书写是解题关键,比较简单.

练习册系列答案
相关题目
14.室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
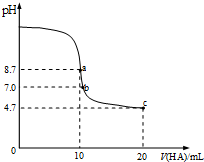

| A. | a点所示溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) | |
| B. | a~b段溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) | |
| C. | pH=7时的溶液中:c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中:c(HA)>c(Na+)>c(A-) |
12.在0.1 mol•L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
19.某有机物2.3克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重2.7克与4.4克,该有机物可能是( )
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C2H6O |
16.下列说法正确的是( )
| A. | 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 | |
| B. | 用排水集气法便可以收集到氯气 | |
| C. | 氯气有漂白性 | |
| D. | 自来水常用氯气来杀菌、消毒 |
13.在密闭容器中发生可逆反应CO(气)+H2O(气)?CO2(气)+H2(气)(正反应为放热反应),仅改变下列条件,不能使正反应速率增大的是( )
| A. | 升高温度 | B. | 增大密闭容器的容积 | ||
| C. | 使用催化剂 | D. | 增大压强 |
14.已知某些共价键的键能如下表所示,火箭燃料肼(N2H4)的燃烧的热化学方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-5 akJ•mol-1则O-H的键能为( )
| 共价键 | N-N | N-H | O=O | N≡N |
| 键能kJ•mol-1 | 3a | 2.5a | 4a | 8a |
| A. | 2a kJ•mol-1 | B. | 2.5a kJ•mol-1 | C. | 3a kJ•mol-1 | D. | 3.5a kJ•mol-1 |