题目内容
 “粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.
“粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.已知:4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓(蓝色).
5SO32-+2IO3-+2H+═5SO42-+I2+H2O (较快); I2+SO32-+H2O═2I-+SO42-+2H+(快)
I.某兴趣小组用0.2mol?L1KIO3、0.5mol?L1Na2SO3、0.2mol?L1H2SO4、0.2%淀粉溶液等试剂,探究反应条件对化学反应速率的影响.
(1)向KIO3、H2SO4、淀粉的混合溶液中加入一定量的Na2SO3溶液,当溶液中的
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 体积V/mL | ||||
| KIO3溶液 | 水 | H2SO4溶液 | Na2SO3溶液 | 淀粉溶液 | |
| ① | 12.0 | 0.0 | 6.0 | 10.0 | 2.0 |
| ② | 10.0 | X | 6.0 | 10.0 | 2.0 |
| ③ | 11.0 | 1.0 | 6.0 | 10.0 | 2.0 |
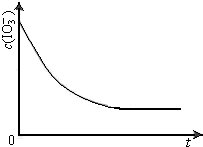
(3)已知某条件下,c(IO3-)~反应时间t的变化曲线如图所示,若保持其它条件不变,请在答题卡坐标中,分别画出降低反应温度和加入催化剂时c(IO3-)~反应时间t的变化曲线示意图(进行相应标注).
II.“粤盐”精制盐中亚铁氰化钾的检验
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量精制盐样品于洁净试管中,加入适量蒸馏水 | 得到无色溶液 | |
| ② | 试样含有K+ | ||
| ③ |
考点:探究影响化学反应速率的因素,化学平衡的影响因素
专题:实验设计题,基本概念与基本理论
分析:Ⅰ(1)由所给的反应可知,SO32-能将IO3-先还原为I2,然后再还原为I-,而且考虑到两步反应的快慢的问题,故当SO32-消耗完时,I2有剩余,据此分析.
(2)探讨反应物浓度对化学反应速率的影响,由控制变量法可知,只改变KIO3的浓度即可,实验2与3作对比;
(3)温度降低反应速率减小,浓度比原来的大,使用催化剂,反应速率加快,浓度不变,以此画出c(IO3-)~t的变化曲线示意图.
Ⅱ①钾元素的检验用焰色反应;
②[Fe(CN)6]4-的检验用铁盐,产生蓝色沉淀.
(2)探讨反应物浓度对化学反应速率的影响,由控制变量法可知,只改变KIO3的浓度即可,实验2与3作对比;
(3)温度降低反应速率减小,浓度比原来的大,使用催化剂,反应速率加快,浓度不变,以此画出c(IO3-)~t的变化曲线示意图.
Ⅱ①钾元素的检验用焰色反应;
②[Fe(CN)6]4-的检验用铁盐,产生蓝色沉淀.
解答:
解:Ⅰ(1)由所给的反应可知,SO32-能将IO3-先还原为I2,然后再还原为I-:2IO3-
I2
2I-,由于第二步反应更快,故一开始溶液无颜色变化,后当SO32-消耗完时,I2有剩余,遇到溶液中的淀粉使溶液由无色变为蓝色;当n(SO32-):n(IO3-)=6:2=3时,两者恰好完全反应无I2剩余,而要想观察到颜色变化,须反应过后I2有剩余,即需n(SO32-):n(IO3-)<6:2=3时,故答案为:SO32-; 无色;蓝色;<3;
(2)探讨反应物浓度对化学反应速率的影响,由控制变量法可知,只改变KIO3的浓度即可,实验2与3作对比,则V=2.0mL,故答案为:2.0;保持总体积相同,仅改变IO3-浓度.
(3)温度降低,IO3-离子的浓度变化比原来时小,反应需要的时间大于原来需要的时间,使用催化剂,反应速率加快,浓度不变,则c(IO3-)~t的变化曲线示意图为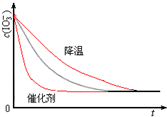 ,图中最上方为降低温度,最下方为使用催化剂,答:图象为
,图中最上方为降低温度,最下方为使用催化剂,答:图象为 .
.
II.亚铁氰化钾是一种可溶性盐,故其存在的检验可以分为检验K+和[Fe(CN)6]4-.
①K+的检验用焰色反应,具体的操作为:将洁净的铂丝灼,烧蘸取①的溶液在无色火焰上灼烧 (透过蓝色钴玻璃观察),若火焰呈紫色,说明含有K+;
②[Fe(CN)6]4-的检验利用其能和Fe3+产生蓝色沉底,故操作方法为:取少取①所得溶液于洁净试管中,加入FeCl3溶液,产生蓝色沉淀,说明试样中含有[Fe(CN)6]4-,结合②则含有 K4[Fe(CN)6],故答案为:
| 5SO32- |
| SO32- |
(2)探讨反应物浓度对化学反应速率的影响,由控制变量法可知,只改变KIO3的浓度即可,实验2与3作对比,则V=2.0mL,故答案为:2.0;保持总体积相同,仅改变IO3-浓度.
(3)温度降低,IO3-离子的浓度变化比原来时小,反应需要的时间大于原来需要的时间,使用催化剂,反应速率加快,浓度不变,则c(IO3-)~t的变化曲线示意图为
 ,图中最上方为降低温度,最下方为使用催化剂,答:图象为
,图中最上方为降低温度,最下方为使用催化剂,答:图象为 .
.II.亚铁氰化钾是一种可溶性盐,故其存在的检验可以分为检验K+和[Fe(CN)6]4-.
①K+的检验用焰色反应,具体的操作为:将洁净的铂丝灼,烧蘸取①的溶液在无色火焰上灼烧 (透过蓝色钴玻璃观察),若火焰呈紫色,说明含有K+;
②[Fe(CN)6]4-的检验利用其能和Fe3+产生蓝色沉底,故操作方法为:取少取①所得溶液于洁净试管中,加入FeCl3溶液,产生蓝色沉淀,说明试样中含有[Fe(CN)6]4-,结合②则含有 K4[Fe(CN)6],故答案为:
| ② | 将洁净的铂丝灼,烧蘸取①的溶液在无色火焰上灼烧 (透过蓝色钴玻璃观察) | 火焰呈紫色 | |
| ③ | 取少取①所得溶液于洁净试管中,加入FeCl3溶液 | 生成蓝色沉淀 | 试样含有[Fe(CN)6]4-,结合②则含有 K4[Fe(CN)6] |
点评:本题考查探究化学反应速率的影响因素,明确反应的现象及控制变量法、影响反应速率及平衡的因素等即可解答,题目难度中等.

练习册系列答案
相关题目
标准状况下,由A、B气态烃组成的混合气体2.24L,完全燃烧后生成4.50g水与7.7g CO2该烃的组成可能的是( )
| A、CH4、C2H6 |
| B、CH4、C3H8 |
| C、CH4、C3H6 |
| D、CH4、C4H8 |
下列关于糖类的说法正确的是( )
| A、所有糖类物质都有甜味,但不一定都溶于水 |
| B、葡萄糖和果糖性质不同,但分子式相同 |
| C、葡萄糖和蔗糖不是同分异构体,但属于同系物 |
| D、葡萄糖、果糖和蔗糖都能发生水解反应 |
在105℃时1L两种气态混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10.5L,再将气体通过碱石灰,体积缩小6L.则下列各组混合烃中符合此条件的是( )
| A、CH4,C4H8 |
| B、CH4,C4H10 |
| C、C2H4,C3H8 |
| D、C2H2,C4H10 |

