题目内容
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极.

(1)为了去除粗盐中混油的Ca2+、Mg2+、SO42-.下列选项中所加试剂(均为溶液)及加入顺序均合理的是 (填选项字母)
A.先加足量的Ba(OH)2,再加足量的Na2CO3,最后加入适量稀盐酸
B.先加入足量的NaOH.再加入足量的Na2CO3,然后加入BaCL2,最后加入适量稀盐酸.
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入适量稀盐酸.
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入适量稀盐酸.
(2)丙电极为 极,该电极的电极反应方程式 .
(3)乙电极附近溶液的pH (填“增大”、“减小”或“不变”).
(4)若装置中通过0.5 mol e-时,理论上生成标准状况下X的体积为 .
(5)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为 .
(6)这样设计的主要节能之处在于(任写一条) .

(1)为了去除粗盐中混油的Ca2+、Mg2+、SO42-.下列选项中所加试剂(均为溶液)及加入顺序均合理的是 (填选项字母)
A.先加足量的Ba(OH)2,再加足量的Na2CO3,最后加入适量稀盐酸
B.先加入足量的NaOH.再加入足量的Na2CO3,然后加入BaCL2,最后加入适量稀盐酸.
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入适量稀盐酸.
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入适量稀盐酸.
(2)丙电极为
(3)乙电极附近溶液的pH
(4)若装置中通过0.5 mol e-时,理论上生成标准状况下X的体积为
(5)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为
(6)这样设计的主要节能之处在于(任写一条)
考点:电解原理
专题:电化学专题
分析:(1)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(2)燃料电池中燃料在负极失电子发生氧化反应;
(3)电解池的阴极上是氢离子得电子的还原反应;
(4)根据电极反应式结合电子转移来计算;
(5)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大;
(6)燃料电池和电解池相组合的新工艺能量转化可以相互补充.
(2)燃料电池中燃料在负极失电子发生氧化反应;
(3)电解池的阴极上是氢离子得电子的还原反应;
(4)根据电极反应式结合电子转移来计算;
(5)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%,可知NaOH浓度增大;
(6)燃料电池和电解池相组合的新工艺能量转化可以相互补充.
解答:
解:(1)要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,故选:A;
(2)该装置的左边是电解池,右边是燃料电池,通入空气的电极是正极,所以丙是负极,是燃料氢气发生失电子的氧化反应,碱溶液中生成水,即H2-2e-+2OH-=2H2O,故答案为:负;H2-2e-+2OH-=2H2O;
(3)丙是燃料电池的负极,所以乙电极是电解池的阴极,该极上氢离子得电子,所以碱性增强,pH增大,故答案为:增大;
(4)甲电极是阳极,该极上产生氯气,根据电极反应:2Cl--2e-=Cl2↑,若装置中通过0.5 mole-时,理论上生成标准状况下氯气的物质的量是0.25mol,X的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(5)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%大于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%>a%,得到b%>a%>c%,故答案为:b%>a%>c%;
(6)燃料电池化学能转化为电能,为电解池提供电源,并且氢氧化钠的产出浓度会提高,所以燃料电池可以补充电解池消耗的电能(提高产出碱液的浓度;降低能耗),
故答案为:燃料电池可以补充电解池消耗的电能(提高产出碱液的浓度;降低能耗).
(2)该装置的左边是电解池,右边是燃料电池,通入空气的电极是正极,所以丙是负极,是燃料氢气发生失电子的氧化反应,碱溶液中生成水,即H2-2e-+2OH-=2H2O,故答案为:负;H2-2e-+2OH-=2H2O;
(3)丙是燃料电池的负极,所以乙电极是电解池的阴极,该极上氢离子得电子,所以碱性增强,pH增大,故答案为:增大;
(4)甲电极是阳极,该极上产生氯气,根据电极反应:2Cl--2e-=Cl2↑,若装置中通过0.5 mole-时,理论上生成标准状况下氯气的物质的量是0.25mol,X的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(5)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%大于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%>a%,得到b%>a%>c%,故答案为:b%>a%>c%;
(6)燃料电池化学能转化为电能,为电解池提供电源,并且氢氧化钠的产出浓度会提高,所以燃料电池可以补充电解池消耗的电能(提高产出碱液的浓度;降低能耗),
故答案为:燃料电池可以补充电解池消耗的电能(提高产出碱液的浓度;降低能耗).
点评:本题考查原电池与电解池,明确电极的判断及发生的电极反应为解答的关键,注意利用电子守恒进行计算,注重基础知识的考查,题目难度不大

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
下列化学式只表示一种纯净物的是( )
| A、C2H6 |
| B、C4H10 |
| C、C2H4Cl2 |
| D、C |
下列物质①氕、氘、氚 ②乙酸和甲酸甲酯 ③C60、N60④金刚石和石墨,其中依次属于同位素、同素异形体、同分异构体的是( )
| A、①、③、② |
| B、①、③、④ |
| C、①、④、② |
| D、④、③、① |
下列叙述正确的是( )
| A、工业上用电解熔融氯化钠的方法制取钠 |
| B、钠加入氯化镁的饱和溶液中可以制取金属镁 |
| C、电解冶炼铝的原料是氯化铝 |
| D、电解氯化镁溶液来制取镁 |
元素周期表短周期的一部分,且M、X、Y、Z为主族元素,下列说法正确的是( )
| M | ||
| X | Y | Z |
| A、Y的氢化物的沸点一定比M的氢化物的沸点高 |
| B、Z的最高价氧化物对应的水化物有可能是弱电解质 |
| C、这四种元素形成的晶体单质都是分子晶体 |
| D、单质M的晶体中可能含有共价键和分子间作用力 |
 工业上利用电解饱和食盐水可制得重要化工产品,该工业又称为“氯碱工业”.
工业上利用电解饱和食盐水可制得重要化工产品,该工业又称为“氯碱工业”. 4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).
4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).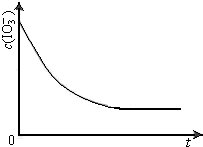 “粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.
“粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.