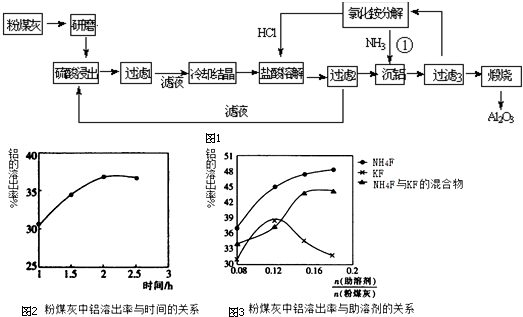
题目内容
7.请回答:(1)HClO的电子式为
 .
.(2)甲硅烷是一种无色无味的气体,结构类似于甲烷,在空气中能自燃,已知它的热值为akJ•g-1,则它的标准燃烧热为△H=-32akJ/mol.
(3)土壤呈碱性有很多原因,其中包括某些强碱弱酸盐(如Na2CO3)的水解,可以加入固体石膏(CaSO4•2H2O)来进行改良,用离子方程式表示原理CO32-+CaSO4=SO42-+CaCO3↓.
(4)配平氧化还原反应的离子方程式1Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O.
分析 (1)次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构;
(2)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位;
(3)Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠;
(4)反应中Cr2O72-→Cr3+,Cr元素由+6价降低为+3价,共降低6价,NO2-→NO3-,N元素由平均化合价+3价升高为+5价,共升高2价,化合价最小公倍数为6,Cr2O72-的系数为1,NO2-的系数为3,再根据原子守恒、电荷守恒配平其它物质系数,据此解答.
解答 解:(1)H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(2)由于硅烷的热值为akJ•g-1,则1molSiH4燃烧放出的热量为:32akJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O(l);△H=-32akJ/mol,
故答案为:-32akJ/mol;
(3)石膏是主要成分是CaSO4,Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠,硫酸根离子和钠离子不水解,则其溶液呈中性,所以石膏能降低其碱性,反应方程式为CO32-+CaSO4=SO42-+CaCO3↓,故答案为:CO32-+CaSO4=SO42-+CaCO3↓;
(4)反应中Cr2O72-→Cr3+,Cr元素由+6价降低为+3价,共降低6价,NO2-→NO3-,N元素由平均化合价+3价升高为+5价,共升高2价,化合价最小公倍数为6,Cr2O72-的系数为1,NO2-的系数为3,再根据原子守恒、电荷守恒配平其它物质系数,配平后的方程式为Cr2O72-+3NO2-+8H+→2Cr3++3NO3-+4H2O,
故答案为:1;3;8H+;2;3;4H2O.
点评 本题考查氧化还原反应配平、燃烧热的计算和电子式的书写,难度中等,应注意基础的掌握.

| A. | 原子半径:Z>W>Y>X | |
| B. | X的简单氢化物与足量W单质在光照条件下反应生成物均为气体 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | Y的最高价氧化物对应的水化物可与其简单氢化物发生化合反应 |
| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 质谱 | D. | 银镜反应 |
| A. | CH≡CH+2Br2→CHBr2-CHBr2 | B. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | ||
| C. |  +HCN$\stackrel{催化剂}{→}$ +HCN$\stackrel{催化剂}{→}$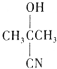 | D. | CH3COOH+NH3$\stackrel{△}{→}$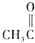 -NH2+H20 -NH2+H20 |
| A. | 某些强氧化剂(如氯酸钾、高锰酸钾等)或其混合物不能研磨,否则易引起爆炸 | |
| B. | 达到滴定终点后,静置1~2min再读数,主要是为了防止管壁有液体残留引起误差 | |
| C. | 在用简易量热计测定反应热时,一般采取下列实验措施:使用碎泡沫起隔热保温、用普通玻璃棒进行搅拌,准确读取反应前后温度、取2~3次的实验平均值 | |
| D. | 某溶液可能含有SO42-和Cl-,可先加足量的硝酸钡,取上层清液再加稀硝酸和硝酸银,来检验其中的Cl- |
| A. | 均为ⅠA族元素,最外层均有1个电子 | |
| B. | 单质的还原性:Li>Na>K>Rb>Cs | |
| C. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| D. | 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大 |
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 氧原子的结构示意图: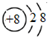 | |
| C. | 过氧化氢的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃l0mL 5mol/L的X溶液 | ||
| C. | 20℃30mL 2mol/L的X溶液 | D. | 10℃l0mL2mol/L的X溶液 |