题目内容
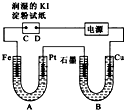 电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:(1)A中发生反应的化学方程式为
(2)在B中观察到的现象是
(3)室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液的pH为
考点:电解原理
专题:电化学专题
分析:(1)B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极E为负极,F为正极;A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气;
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,阴极生成氢气,溶液生成氢氧化铜沉淀;
(3)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L,计算氧气的物质的量并计算电子转移的情况据此计算pH.
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,阴极生成氢气,溶液生成氢氧化铜沉淀;
(3)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L,计算氧气的物质的量并计算电子转移的情况据此计算pH.
解答:
解:(1)B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极E为负极,F为正极,
A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O
4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3;
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:Cu棒周围开始时变蓝色,石墨上有气泡产生,一段时间后,U形管B的底部有沉淀;
(3)A、B装置中共收集到标准状况下的气体0.0168L,应分别为氧气和氢气,则氧气为0.0168L×
=0.0056L,n(02)=
=0.00025mol,转移电子0.001mol,A中盛有AgNO3溶液,电解时生成硝酸,n(H+)=n(e-)=0.001mol,则c(H+)=
=0.001mol/L,则pH=3,
故答案为:3.
A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O
| ||
故答案为:4AgNO3+2H2O
| ||
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:Cu棒周围开始时变蓝色,石墨上有气泡产生,一段时间后,U形管B的底部有沉淀;
(3)A、B装置中共收集到标准状况下的气体0.0168L,应分别为氧气和氢气,则氧气为0.0168L×
| 1 |
| 3 |
| 0.0056L |
| 22.4L/mol |
| 0.001mol |
| 1L |
故答案为:3.
点评:本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 除杂 |
B、 稀释 |
C、 制气 |
D、 称量 |
 石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是( )
石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是( )| A、10个 | B、14个 |
| C、18个 | D、21个 |
常温下,将V1mL c1 mol/L的醋酸溶液滴加到V2 mL c2 mol/L的氢氧化钠溶液中,下列结论正确的是( )
| A、若V1=V2,且溶液的pH>7,则一定有c1<c2 |
| B、若混合液的pH=7,则一定有c1v1>c2v2 |
| C、若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
| D、若c1V1=c2V2,则混合溶液中有c(OH-)>c(CH3COOH)+c(H+) |
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度浓度应满足的关系是( )
| A、c(M+)>c(A-)>c( OH-)>c(H+) |
| B、c(M+)>c(A-)>c(H+)>c( OH-) |
| C、c(M+)>c( OH-)>c(A-)>c(H+) |
| D、c(M+)>c(H+)=c( OH-)>c(A-) |
氢离子浓度相同的等体积的盐酸A和醋酸B,分别和锌反应,若最后仅有一种溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间 B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量 A=B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余
⑥醋酸里有锌剩余.
①反应所需要的时间 B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量 A=B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余
⑥醋酸里有锌剩余.
| A、③④⑥ | B、②③⑥ |
| C、③④⑤ | D、①②⑤ |
烧碱、醋酸和醋酸钠等是生活中的常见物质.下列有关它们的表述正确的是( )
| A、将烧碱逐滴加入醋酸溶液中至溶液呈中性,则该混合液中还有少量醋酸未被中和 |
| B、将0.1 mol?L-1 CH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、H+浓度都逐渐增大 |
| C、将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、常温下,将pH=12的烧碱溶液与pH=2的醋酸溶液等体积混合,所得混合液的pH>7 |
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液.下列说法中不正确的是(忽略混合前后溶液体积变化)( )
| A、溶液的pH值:②>③>① |
| B、水电离出的c(OH-):③>①>② |
| C、①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.05mol/L |
| D、室温,碳酸钙在①中的ksp比在水中的大 |
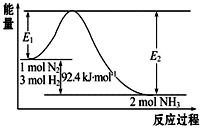 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题: