题目内容
18. 已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )
已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)较小 | |
| B. | 在t2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2时的平衡常数分别为K1、K2,则K1<K2 |
分析 A.根据温度对平衡的影响,分析CO的浓度;
B.T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行;
C.由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动;
D.化学平衡常数只受温度影响,升高温度平衡向吸热反应移动,根据平衡移动判断温度对平衡常数的影响.
解答 解:A.平衡状态A与C相比,C点温度高,已知△H>0,升高温度平衡正移,CO浓度减小,所以A点CO浓度大,故A错误;
B.T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行,则一定有υ(正)<υ(逆),故B正确;
C.由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故正反应是吸热反应,即△H>0,故C正确;
D.该反应正反应是吸热反应,升高温度平衡向正反应移动,化学平衡常数增大,故K1<K2,故D正确;
故选A.
点评 本题考查温度对平衡移动的影响、对化学平衡常数的影响等知识,题目难度中等,注意曲线的各点都处于平衡状态,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
8.在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}×{10^{-18}}mol/L$ |
9.实验室需配置100mL2.00mol/LNaCl溶液,请你参与实验过程,并完成相关实验报告(填写表格中横线上所示内容).
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水搅拌. (4)转移、洗涤:将烧杯中的溶液注入容量瓶中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用 胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (7)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
3.常温下,下列叙述错误的是( )
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
10.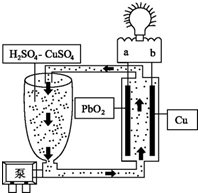 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为正极,b为负极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | b极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
7. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4的正四面体形、H2O为V形.
(5)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O
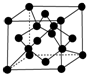
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为ρ g•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$ cm(用代数式表示).
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4的正四面体形、H2O为V形.
(5)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为ρ g•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$ cm(用代数式表示).
8.同一周期X、Y、Z三种短周期元素,它们的气态氢化物的化学式分别为H2X、YH3、ZH4,下列说法不正确的是( )
| A. | 气态氢化物的稳定性:H2X<YH3<ZH4 | |
| B. | 最高价氧化物对应的水化物酸性:H2XO4>H3YO4>H2ZO3 | |
| C. | 元素的最高正化合价:X>Y>Z | |
| D. | 元素原子的半径:X<Y<Z |
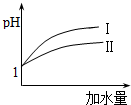 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.