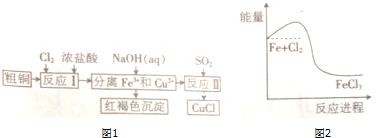
题目内容
3.节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨.甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2?CH3OH.请根据图示回答下列问题:

(1)关于该反应的下列说法中,正确的是C(填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,净测得CO和CH3OH(g)的浓度随时间变化如(图1)所示.从反应开始到平衡,CO的平均反应速率v(CO)=0.075mol/(L•min),该反应的平衡常数K=$\frac{4}{3}$.
(3)恒容条件下,达到平衡后,下列措施中能使$\frac{n({CH}_{3}OH)}{n(CO)}$增大的有C.
A.升高温度 B.充入He气
C.再冲入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量=25.6g/mol.
(5)根据(图2),写出此反应的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.
分析 (1)根据方程式可知,该反应为气体体积减小的反应,根据图2可知,生成物质能量低于反应;
(2)根据图I时,反应中CO浓度的变化,结合速率公式计算,根据K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$计算平衡常数;
(3)恒容条件下,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(CO)}$增大,则平衡正移,据此分析;
(4)根据平均摩尔质量=$\frac{总质量}{总物质的量}$计算;
(5)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式.
解答 解:(1)根据方程式可知,该反应为气体体积减小的反应,所以该反应△S<0,根据图2可知,生成物质能量低于反应,所以△H<0,
故答案为:C;
(2)由图I可知,反应中CO浓度的变化为:1.00-0.25=0.75mol•L-1,则v(CO)=$\frac{△c}{t}$=$\frac{0.75mol•{L}^{-1}}{10min}$=0.075mol/(L•min),根据图可知,平衡时c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,c(H2)=1.5mol/L,K═$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.7{5}^{2}}{1.{5}^{2}×0.25}$=$\frac{4}{3}$,
故答案为:0.075mol/(L•min);$\frac{4}{3}$;
(3)恒容条件下,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(CO)}$增大,则平衡正移;
A.已知该反应的正方向为放热反应,升高温度,平衡逆移,故A错误;
B.充入He气,容器的体积不变,各反应物的浓度不变,平衡不移动,故B错误;
C.再充入1molCO和2molH2,与原来加入了的量等比例,平衡时比原来的平衡的压强增大,平衡正移,故C正确;
D.使用催化剂,同等程度的改变正逆反应速率,平衡不移动,故D错误;
故答案为:C;
(4)由平衡时密度可知,平衡后混合气体的物质的量为起始时的$\frac{1}{1.6}$,平衡时总物质的量为(1mol+2mol+1mol)×$\frac{1}{1.6}$=2.5mol,总质量为1×28g+2×2g+1×32g=64g,所以平均摩尔质量=$\frac{64g}{2.5mol}$=25.6g/mol,
故答案为:25.6;
(5)反应物的总能量为419kJ,生成物的总能量为510kJ,则该反应为放热反应,放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.
点评 本题为综合性习题,考查影响化学平衡的因素、热化学反应、化学平衡常数、反应速率的计算,图象的分析和利用等知识点,注重对高考热点知识的考查,是较好的习题,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
| A. | 该反应是放热反应 | |
| B. | 加入催化剂后,反应加快,△H减小 | |
| C. | 反应物的总键能小于生成物的总键能 | |
| D. | 反应达到平衡时,升高温度,A的转化率增大 |
| A. | 丙烷(丙烯),酸性高锰酸钾溶液 | B. | 甲烷(乙炔),溴的四氯化碳溶液 | ||
| C. | 溴苯(溴),苯 | D. | 硝基苯(硝酸),苯和浓硫酸 |
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
TiO2-→TiCl4$\stackrel{酶/800℃/Ar}{→}$Ti
已知:①C(s)+O2(g)═CO2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H3
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H为( )
| A. | △H3+2△H1+2△H2 | B. | △H3+2△H1+△H2 | C. | △H3+2△H1-△H2 | D. | △H3+2△H1-2△H2 |
| A. | 0.92g | B. | 0.69g | C. | 0.46g | D. | 0.23g |

图中的M是短周期金属元素,M的部分电离能如表:请回答下列问题:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 1054 0 | 13630 |
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C;
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{N}_{A}×(2a×1{0}^{-10})^{3}}$ g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个;
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
 .
.