题目内容
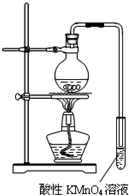
19.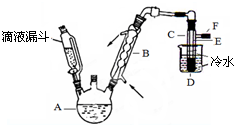 图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.
图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| 水溶性 | 易溶 | 难溶 | 微溶 |
(2)若选用较浓的硫酸作为反应物,得到的产品则会呈棕黄色,这说明反应过程中有Br2生成.为去除颜色,最好选择下列的d溶液来洗涤产品.
a.四氯化碳 b.硫酸钠 c.碘化亚铁 d.亚硫酸钠
产品选择上述溶液洗涤后,还需再用蒸馏水洗涤一次.洗涤液与产品分离的方法是分液(填方法名称).
(3)装置中,B和D两部分的作用分别是:B冷凝回流反应物,冷却产物蒸汽;D冷凝产品.
分析 (1)加热温度较低时NaBr与硫酸反应生成NaHSO4与HBr,HBr与乙醇发生取代反应生成CH3CH2Br与水;
(2)用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,是因为溶解了溴,洗涤除去溴:
a.加四氯化碳,溴乙烷、溴单质都会溶解;
b.硫酸钠和溴单质不反应不能除去;
c.碘化亚铁会引入碘单质杂质;
d.加亚硫酸钠只与溴反应不与溴乙烷反应;
洗涤后需要通过分液进行分离,洗涤需要在分液装置中进行,用烧杯接取水层溶液.
(3)仪器B为球形冷凝管,起到冷凝回流的作用,仪器D为冰水冷却生成的产品;
解答 解:(1)加热温度较低时NaBr与硫酸反应生成NaHSO4与HBr,HBr与乙醇发生取代反应生成CH3CH2Br与水,反应反应方程式为:CH3CH2OH+NaBr+H2SO4$\stackrel{△}{→}$NaHSO4+CH3CH2Br+H2O,
故答案为:CH3CH2OH+NaBr+H2SO4$\stackrel{△}{→}$NaHSO4+CH3CH2Br+H2O;
(2)用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,是因为溶解了Br2,洗涤除去溴:
a.四氯化碳可以溶解溴单质,但也会溶解溴乙烷,故a错误;
b. 硫酸钠不能除去溴单质,故b错误;
c.溴与碘化亚铁会生成碘单质,溴乙烷会溶解碘单质,故c错误;
d.加亚硫酸钠只与溴发生反应,不与溴乙烷反应,故d正确;
洗涤后需要通过分液进行分离,洗涤需要用分液方法分离,用烧杯接取水层溶液,
故答案为:Br2;d;分液;
(3)仪器B为球形冷凝管,应采取逆流原理通入冷凝水,进行充分冷凝回流,即冷却水应冷凝管的下口流入,从上口流出,B的作用为:冷凝回流反应物,冷却产物蒸汽,仪器D为冷凝装置,利用冰水冷却试管得到所处的产品,
故答案为:冷凝回流反应物,冷却产物蒸汽;冷凝产品;
点评 本题考查了 的制备原理、制备实验方法、实验过程分析判断、仪器使用、物质性质和实验基本操作的熟练掌握是解题关键,题目难度中等.

反应原理:
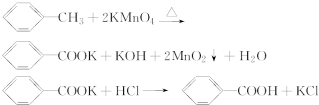
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
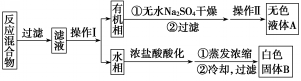
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结果 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$\underset{\stackrel{N{a}_{2}C{r}_{2}{O}_{7}}{→}}{{H}_{2}S{O}_{4}加热}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,D仪器的名称是直形冷凝管,E仪器的名称是锥形瓶.
(3)C1、C2温度计水银球位置不同的原因是C1控制反应温度;C2测定蒸馏出来气体的温度
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:①含有与正丁醇相同的官能团;②一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
| A. | 平衡向正反应方向移动 | |
| B. | 平衡向逆反应方向移动 | |
| C. | 平衡不移动,但容器内的压强将增大 | |
| D. | 平衡不移动,且容器内的压强不变 |
| A. | 2LCO和2LCO2 | B. | 9g H2O和标准状况下11.2LCO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和22.4LHCl气体 |
| A. | 氯酸钾是还原剂 | |
| B. | KCl既是氧化产物,又是还原产物 | |
| C. | 反应中消耗3mol P时,转移电子的物质的量为15mol | |
| D. | 发令时产生的白烟只是KCl固体颗粒 |
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).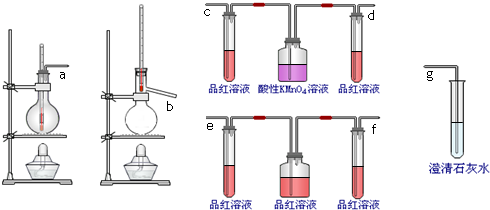
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.