题目内容
18.下列过程中反应离子方程式正确的是( )| A. | 用漂白液漂洗衣物:H2O+2NaClO+CO2═2HClO+CO32-+2Na+ | |
| B. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq) | |
| C. | 用氢氧化钠溶液处理工业含二氧化硫的尾气:SO2+2OH-═HSO3-+H2O | |
| D. | 用加少量铁粉的方法存放硫酸亚铁溶液:Fe3++Fe═2Fe2+ |
分析 A.次氯酸钠为易溶的强电解质,应该拆开,且反应生成碳酸氢根离子;
B.碳酸钙更难溶,实现的沉淀的转化;
C.氢氧化钠少量,反应生成亚硫酸根离子;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.用漂白液漂洗衣物,次氯酸钠与二氧化碳反应生成次氯酸和碳酸氢钠,次氯酸钠应该拆开,正确的离子方程式为:H2O+ClO-+CO2═HClO+HCO3-,故A错误;
B.碳酸钙比硫酸钙难溶物,可用碳酸钠溶液浸泡锅炉水垢,反应的离子方程式为:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq),故B正确;
C.用氢氧化钠溶液处理工业含二氧化硫的尾气,反应生成亚硫酸钠和水,正确的离子方程式为:SO2+2OH-═SO32-+H2O,故C错误;
D.用加少量铁粉的方法存放硫酸亚铁溶液,原理是铁与铁离子反应生成亚铁离子,正确的离子方程式为:2Fe3++Fe═3Fe2+,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
8.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加入水,平衡向逆反应方向移动 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中C(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
9.纯碱是一种非常重要的化工原料,纯碱属于( )
| A. | 碱 | B. | 盐 | C. | 氧化物 | D. | 有机物 |
6.下列关于有机化合物的结构说法正确的是( )
| A. | 苯分子中含有碳碳双键 | B. | 氨基酸分子中可能含有手性碳原子 | ||
| C. | 己烷有3种同分异构体 | D. | 乙酸分子中所有原子处于同一平面 |
13.CPAE是蜂胶的主要成分,苯乙醇是合成CPAE的一种原料.
 →
→
下列说法正确的是( )
 →
→
下列说法正确的是( )
| A. | 苯乙醇分子中含有1个手性碳原子 | |
| B. | 与苯乙醇互为同分异构体的芳香醇有4种 | |
| C. | 苯乙醉及CPAE都能发生取代、加成和消去反应 | |
| D. | 1 mol CPAE最多可与含3 molNaOH的溶液发生反应 |
3.下列有关分枝酸的叙述中,正确的是( )
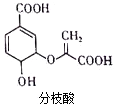

| A. | 分子中含有2种官能团 | |
| B. | 一定条件下,能与乙醇或乙酸发生相同类型的反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生反应 | |
| D. | 可运用同一原理分别使溴的四氯化碳溶液与酸性高锰酸钾溶液褪色 |
10.油条和豆浆是我国传统的早餐食物,炸油条时常用到一种白色物质,它既能中和发酵过程中产生的酸,又能起发泡作用,这种白色物质是( )
| A. | NaOH | B. | Ca(OH)2 | C. | NaHCO3 | D. | NaCl |
7.设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,8.0gCH4中含有的氢原子数为NA | |
| B. | 1mol氯气跟水完全反应,转移的电子数为2NA | |
| C. | 1 molNa2O2跟足量CO2完全反应,转移的电子数为NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
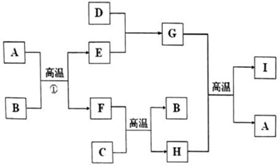 有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中.
有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. .
.