题目内容
氯气性质很活泼,它具有较强的氧化性,下列叙述中不正确的是( )
| A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B、因为氯气能和Fe反应,所以液氯不能装在干燥的钢瓶里 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合发生爆炸 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
考点:氯气的化学性质
专题:卤族元素
分析:A、铜与氯气反应生成固体氯化铜;
B、根据氯气和Fe在点燃的条件下反应,在常温下不反应判断;
C、氢气不纯,容易发生爆炸,纯净的氢气能在Cl2中安静地燃烧;
D、由Cl2+H2O?HClO+HCl,2HClO
2HCl+O2↑来分析.
B、根据氯气和Fe在点燃的条件下反应,在常温下不反应判断;
C、氢气不纯,容易发生爆炸,纯净的氢气能在Cl2中安静地燃烧;
D、由Cl2+H2O?HClO+HCl,2HClO
| ||
解答:
解:A、因红热的铜丝在氯气里剧烈燃烧生成固体氯化铜,则会观察到棕黄色的烟,故A正确;
B、氯气和Fe在点燃的条件下反应,在常温下不反应,所以液氯能装在干燥的钢瓶里,故B错误;
C、纯净的H2在Cl2中安静地燃烧生成HCl,观察到苍白色火焰,故C正确;
D、氯气能与水反应生成HClO和HCl,久置会发生2HClO
2HCl+O2↑,则最终为稀盐酸,故D正确;
故选B.
B、氯气和Fe在点燃的条件下反应,在常温下不反应,所以液氯能装在干燥的钢瓶里,故B错误;
C、纯净的H2在Cl2中安静地燃烧生成HCl,观察到苍白色火焰,故C正确;
D、氯气能与水反应生成HClO和HCl,久置会发生2HClO
| ||
故选B.
点评:本题考查氯气的化学性质,明确氯气与金属、非金属、与水的反应即可解答,难度不大,注意干燥的氯气不具有漂白性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、c(H+)=10-7mol/L的溶液 |
| C、氨水与氯化铵的混合液中c(NH4+)=c(Cl-) |
| D、c(H+)/c(OH-)=10-14的溶液 |
下列试剂的保存不正确的是( )
| A、漂白粉必须密封保存 |
| B、新制的氯水用棕色瓶保存 |
| C、镁条要密封保存 |
| D、固体钠保存在煤油中 |
下列实验操作正确且能达到目的是( )
| A、结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细大 |
| B、用移液管量取液体,吸取液体后,将移液管垂直放入容器中,管尖与容器内壁不得接触,松开食指使溶液全部流出 |
| C、在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4 |
| D、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
下列说法正确的是( )
| A、滴定用的锥形瓶和滴定管都要用所盛溶液润洗 |
| B、配制一定物质的量浓度的溶液时,所用的容量瓶要预先干燥 |
| C、乙醇、乙酸、乙酸乙酯三种液体可用饱和Na2CO3溶液鉴别 |
D、如图装置可用于分离沸点不同的液体混合物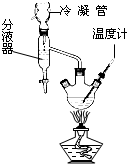 |
下列说法正确的是( )
| A、原电池中的负极质量一定减轻 |
| B、电解精炼铜时精铜做阳极 |
| C、金属被腐蚀的实质是金属原子失电子被氧化 |
| D、钢铁发生吸氧腐蚀时的负极反应为:Fe-3e-=Fe3+ |
下列各离子浓度的大小比较,正确的是( )
| A、0.2 mol?L-1 Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) |
| C、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3?H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D、含有NH4+、Cl-、OH-、H+的溶液中,离子浓度一定是c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
 镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为: