题目内容
 如图所示,甲、乙为相互串联的两电解池.
如图所示,甲、乙为相互串联的两电解池.(1)甲池若为用电解原理精炼铜的装置,则A电极名称为
(2)乙池中Fe极电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)依据电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜;
(2)乙池中Fe极为阴极,阴极阳离子放电,根据反应判断Fe附近的酸碱性.
(2)乙池中Fe极为阴极,阴极阳离子放电,根据反应判断Fe附近的酸碱性.
解答:
解:(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu;
故答案为:阴;纯铜;Cu2++2e-═Cu;含铜离子的盐溶液;
(2)乙池C(石墨)极为电解池的阳极,Fe极为阴极,阴极阳离子放电,则Fe上氢离子得电子生成氢气,其电极反应为:2H++2e-═H2↑,同时Fe电极附近还生成氢氧根离子,所以加酚酞溶液变红色;
故答案为:2H++2e-═H2↑;红.
故答案为:阴;纯铜;Cu2++2e-═Cu;含铜离子的盐溶液;
(2)乙池C(石墨)极为电解池的阳极,Fe极为阴极,阴极阳离子放电,则Fe上氢离子得电子生成氢气,其电极反应为:2H++2e-═H2↑,同时Fe电极附近还生成氢氧根离子,所以加酚酞溶液变红色;
故答案为:2H++2e-═H2↑;红.
点评:本题考查了电解原理的分析判断,装置分析判断电极名称是基础,掌握电化学基本知识是解题关键,题目难度不大.

练习册系列答案
相关题目
在无色透明的酸性溶液中,下列离子不能大量共存的是( )
| A、K+、Mg2+、NO3-、SO42- |
| B、Na+、HCO3-、SO42-、Cl- |
| C、Mg2+、Cl-、Ca2+、NO3- |
| D、Ba2+、NO3-、Ca2+、Cl- |
下列叙述中正确的是( )
| A、已知反应C(s)+H2O(g)=CO(g)+H2(g)在一定温度下非自发,则该反应△H>0 |
| B、室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va:Vb=10:9 |
| C、已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F一)]<[c(K+)-c(CH3COO-)] |
| D、已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
下表为六种短周期元素的部分性质.
下列有关说法一定正确的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.37 | 0.74 | 0.75 | 0.82 | 1.10 | 0.99 |
| 主要化合价 | +1 | -2 | +5、-3 | +3 | +5、-3 | +7、-1 |
| A、X→T原子序数依次增大 |
| B、上述六种元素都是非金属元素 |
| C、元素X、Y、Q形成的化合物水溶液呈碱性 |
| D、元素R的最高氧化物的水化物的酸性比元素Z的强 |
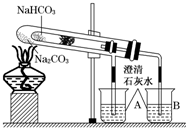 “套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
 置换反应可用如图表示,回答下列问题:
置换反应可用如图表示,回答下列问题: