题目内容
6.根据下表信息,判断以下叙述正确的是( )表中为部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性H2T<H2R | B. | M与T形成的化合物具有两性 | ||
| C. | 单质与稀盐酸反应的快慢为L>Q | D. | L2+与R2-的核外电子数相等 |
分析 短周期元素中,R、T都有-2价,应位于周期表第ⅥA族,其中R有+6价,则T为O元素,R为S元素;L、Q都有+2价,处于ⅡA族,且L的原子半径较大,则L为Mg,Q为Be;M最高正价为+3价,原子半径介于Mg、S之间,可确定M为Al,据此结合元素周期律知识解答.
解答 解:短周期元素中,R、T都有-2价,应位于周期表第ⅥA族,其中R有+6价,则T为O元素,R为S元素;L、Q都有+2价,处于ⅡA族,且L的原子半径较大,则L为Mg,Q为Be;M最高正价为+3价,原子半径介于Mg、S之间,可确定M为Al,
A.由于水分子之间存在氢键,故沸点H2O>H2S,即H2T>H2R,故A错误;
B.M与T形成的化合物是氧化铝,属于两性氧化物,故B正确;
C.金属性Mg比Be强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>Q,故C正确;
D.Mg2+离子核外电子数为10,S2-离子的核外电子数为18,二者核外电子数不相等,故D错误;
故选BC.
点评 本题考查原子结构与元素周期律的关系,难度中等,根据元素化合价与半径确定元素是解题关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 | |
| B. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| C. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 | |
| D. | 石油、煤、天然气、可燃冰、生物柴油都属于化石燃料 |
1.下列关于同系物的叙述中,不正确的是( )
| A. | 烷烃的同系物的分子式可用通式CnH2n+2表示 | |
| B. | 同系物间具有相似的结构 | |
| C. | 两个同系物之间的相对分子质量差为14或14的整数倍 | |
| D. | 甲烷不是乙炔的同系物,但乙烯是乙炔的同系物 |
11.在密闭容器中进行如下反应:X2(气)+Y2(气)?2Z(气),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Z 为 0.3 mol/L | B. | Y2为 0.4 mol/L | C. | X2为 0.2 mol/L | D. | Z 为 0.4 mol/L |
18.下列叙述正确的是( )
| A. | 原子晶体中一定不存在化学键 | B. | 离子晶体中只存在离子键 | ||
| C. | 在共价化合物中一定有共价键 | D. | 非金属原子间只能形成共价化合物 |
16.在盛有少量氯水的试管中加入过量的溴化钾溶液,再加入少量四氯化碳,振荡静置后可观察到的现象是( )
| A. | 溶液呈橙色不分层 | B. | 溶液分两层,上层呈橙色 | ||
| C. | 溶液分两层,下层呈橙色 | D. | 溶液呈紫色不分层 |
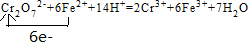 .
.