题目内容
18.按要求书写热化学方程式:①1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1
②稀盐酸和稀NaOH溶液混合的热化学方程式:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1
③2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1
④已知乙醇和乙烯的燃烧热分别为1 366.8kJ•mol-1和1 411.0kJ•mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2 kJ•mol-1
⑤盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
分析 热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,据此解答①②③,
④首先写出乙醇和乙烯燃烧热的热化学方程式,再利用盖斯定律解答;
⑤由盖斯定律Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得,由此分析解答.
解答 解:①1mol氮气完全反应,能生成2mol氨气,放热92.2KJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1;
②中和热为57.3KJ/mol,据此书写为H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,故答案为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1;
③燃烧热是1mol氢气燃烧放出的热量,2g氢气为1mol,其燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1;
④燃烧热是指1mol可燃物完全燃烧生成稳定化合物时放出的热量,所以乙醇和乙烯燃烧的热化学方程式为:
(1)C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366KJ/mol,(2)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411.0KJ/mol
据盖斯定律(2)-(1)得:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2 kJ•mol-1,
故答案为:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2 kJ•mol-1.
⑤Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
点评 本题考查反应热的计算、热化学方程式的书写,题目难度不大,注意盖斯定律的应用,学生在书写热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案[实验设计]控制
p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成如表实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
 [数据处理]
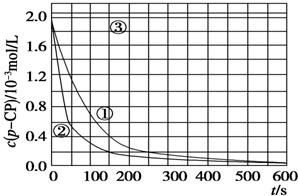
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)请根据如图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=8.0×10-6mol/(L•s).
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
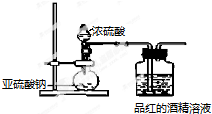
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
| 序号 | 甲 | 乙 | 丙 |
| A | Cl2 | SO2 | Ba(NO3)2 |
| B | HCl | CO2 | 石灰水 |
| C | NH3 | SO2 | Ba(OH)2 |
| D | NO2 | SO2 | BaCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 14 | B. | 28 | C. | 2.8 | D. | 280 |
| A. | 甲烷 | B. | 乙烷 | C. | 乙醇 | D. | 苯乙烯 |
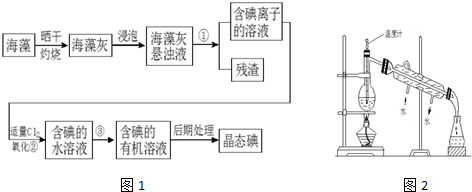

 ,反应类型取代反应
,反应类型取代反应