题目内容
20.下列关于电解质溶液的叙述正确的是( )| A. | 若温度不变,在氨水中加入少量NH4Cl固体.氨水的电离度和电离平衡常数均变小 | |
| B. | 滴加甲基橙显红色的溶液:NH4+、NO3-、I-、Cl-可以大量共存 | |
| C. | 若将等pH、等体积的NaOH溶液和氨水分别加水稀释m倍、n倍.稀释后两种溶液的pH仍相等,m<n | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合,所得溶液呈中性,则Va:Vb=10:1 |
分析 A.电离平衡常数只与温度有关;
B.甲基橙显红色的溶液显酸性,酸性条件下,硝酸根离子有较强的氧化性;
C.pH相等的NaOH和氨水溶液,氨水浓度大于NaOH溶液,加水稀释促进一水合氨电离,NaOH在溶液中完全电离,据此分析;
D.所得混合溶液为中性,根据c(OH-)×Va=c(H+)×Vb计算.
解答 解:A.电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故A错误;
B.甲基橙显红色的溶液显酸性,酸性条件下,硝酸根离子有较强的氧化性,则硝酸根离子能把碘离子氧化,所以NO3-与I-不能共存,故B错误;
C.加水稀释促进一水合氨电离,将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水中氢氧根离子浓度大于NaOH,氨水pH大于NaOH溶液,若使稀释后pH相等,氨水稀释倍数应大于氢氧化钠,即m<n,故C正确;
D.若所得混合溶液为中性,因c(OH-)×Va=c(H+)×Vb,则0.1×Va=0.01Vb,则Va:Vb=1:10,故D错误.
故选C.
点评 本题考查了弱电解质的电离、酸碱混合的计算、离子共存,明确弱电解质电离特点是解本题关键,注意电离平衡常数、水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点,本题综合考查学生的计算能力和分析能力.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
11.某溶液中通人NO2仍能大量共存的离子是( )
| A. | Ag+、Na+、CO32- | B. | H+、Fe2+、Cl- | C. | Cu2+、H+、SO42- | D. | Ba2+、H+、SO42- |
8.将m g Al2O3、Fe2O3的混和物溶解在过量的100mL0.05mol/L的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1mol/L | B. | 0.05mol/L | C. | 0.2mol/L | D. | 无法计算 |
15.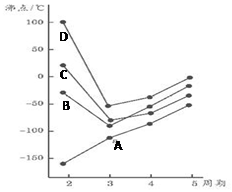 如图为四、五、六、七主族元素简单氢化物沸点随周期变化图象,(A、B、C、D代表氢化物中另外一种元素)分析图象,下列说法正确的是( )
如图为四、五、六、七主族元素简单氢化物沸点随周期变化图象,(A、B、C、D代表氢化物中另外一种元素)分析图象,下列说法正确的是( )
 如图为四、五、六、七主族元素简单氢化物沸点随周期变化图象,(A、B、C、D代表氢化物中另外一种元素)分析图象,下列说法正确的是( )
如图为四、五、六、七主族元素简单氢化物沸点随周期变化图象,(A、B、C、D代表氢化物中另外一种元素)分析图象,下列说法正确的是( )| A. | A元素氧化物晶体中存在分子间作用力 | |
| B. | A、B、C、D非金属性由小到大的顺序是:A<B<D<C | |
| C. | D的氢化物固态比液态时密度大 | |
| D. | B元素一种氢化物可做火箭的染料,为CH4 |
5.在0.1mol•L-1的NaHCO3溶液中,下列关系式正确的是( )
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
12.下列说法中正确的是( )
| A. | 植物油和裂化汽油都能使溴水褪色 | |
| B. | 葡萄糖、蔗糖都能与新制的Cu(OH)2悬浊液发生氧化反应 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔沸点 |
13.下列有关sp杂化轨道的叙述正确的是( )
| A. | 是由一个1s轨道和一个2p轨道线性组合而成 | |
| B. | 等性sp杂化轨道中所含s、p的成分一样 | |
| C. | 等性sp杂化轨道有两个,一个能量升高,另一个能量降低,但总能量保持不变 | |
| D. | sp杂化轨道可与其他原子轨道形成σ键和π键 |
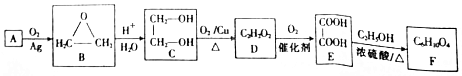
 .
.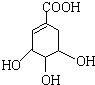 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下: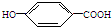 ),其反应类型是消去反应,化学方程式是
),其反应类型是消去反应,化学方程式是 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$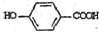 +2H2O.
+2H2O. .
.