题目内容
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:![]() △H1 平衡常数为K1
△H1 平衡常数为K1
反应Ⅱ:![]() △H2 平衡常数为K2
△H2 平衡常数为K2
不同温度下,K1、K2的值如下表:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() ,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
(2)![]() 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种![]() 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅲ:![]() △H3
△H3
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
平衡转化率和平衡时![]() 的选择性随温度的变化如图。
的选择性随温度的变化如图。
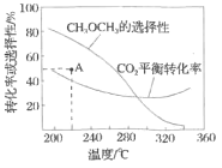
其中:![]() 的选择性
的选择性![]()
①温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是________。
平衡转化率随温度升高而上升的原因是________。
②220℃时,在催化剂作用下![]() 与
与![]() 反应一段时间后,测得
反应一段时间后,测得![]() 的选择性为48%(图中
的选择性为48%(图中![]() 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高![]() 选择性的措施有________。
选择性的措施有________。
(3)石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应Ⅴ:![]()
反应Ⅵ:![]()
一定温度下,向容积为![]() 的密闭容器中通入正丁烷,反应时间
的密闭容器中通入正丁烷,反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 数据如下:
数据如下:
| 0 | 10 | 20 | 30 | 40 |
| 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①反应速率可以用单位时间内分压的变化表示,即v=![]() ,前
,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]() ________
________![]() ,该温度下,正丁烷的平衡转化率
,该温度下,正丁烷的平衡转化率![]() ________。
________。
②若平衡时乙烯的体积分数为![]() ,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
③若反应在恒温、恒压条件下进行,平衡后反应容器的体积________![]() (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
【答案】吸热 反应Ⅲ的△H>0,温度升高使![]() 转化为
转化为![]() 的平衡转化率上升,反应Ⅳ的
的平衡转化率上升,反应Ⅳ的![]() ,温度升高使
,温度升高使![]() 转化为
转化为![]() 的平衡转化率下降:且上升幅度超过下降幅度 增大压强、使用对反应Ⅳ催化活性更高的催化剂 0.17 76% 2.1 大于
的平衡转化率下降:且上升幅度超过下降幅度 增大压强、使用对反应Ⅳ催化活性更高的催化剂 0.17 76% 2.1 大于
【解析】
判断反应Ⅲ:![]() 的△H时,需利用反应Ⅰ与反应Ⅱ,建立平衡常数与K1、K2的关系,然后分别代入973K和1173K两组数据,得出两个温度下的K,比较确定K随温度的变化,便可确定△H与0的关系。温度高于300℃,
的△H时,需利用反应Ⅰ与反应Ⅱ,建立平衡常数与K1、K2的关系,然后分别代入973K和1173K两组数据,得出两个温度下的K,比较确定K随温度的变化,便可确定△H与0的关系。温度高于300℃,![]() 平衡转化率受反应Ⅲ和反应Ⅳ的影响,两个反应进行综合分析,便可得出
平衡转化率受反应Ⅲ和反应Ⅳ的影响,两个反应进行综合分析,便可得出![]() 平衡转化率随温度升高而上升的原因;分析两个反应前后的气体分子数关系,由此确定一定能提高
平衡转化率随温度升高而上升的原因;分析两个反应前后的气体分子数关系,由此确定一定能提高![]() 选择性的措施;利用三段式,可求出
选择性的措施;利用三段式,可求出![]() 内及平衡时各物质的分压,从而求出速率、转化率及分压平衡常数;由体积不变转化为压强不变时,需关注平衡的移动情况。
内及平衡时各物质的分压,从而求出速率、转化率及分压平衡常数;由体积不变转化为压强不变时,需关注平衡的移动情况。
(1) 反应Ⅲ:![]() ,则K=
,则K=![]() =
=![]() ,由表中数据可以看出,973K时,K<1,1173K时,K>1,温度升高,K值增大,则反应Ⅲ是吸热反应。答案为:吸热;
,由表中数据可以看出,973K时,K<1,1173K时,K>1,温度升高,K值增大,则反应Ⅲ是吸热反应。答案为:吸热;
(2)①反应Ⅲ:![]() △H3<0,
△H3<0,
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
升高温度,反应Ⅲ平衡正向移动,![]() 平衡转化率增大,反应Ⅳ平衡逆向移动,
平衡转化率增大,反应Ⅳ平衡逆向移动,![]() 平衡转化率减小,最终结果是
平衡转化率减小,最终结果是![]() 平衡转化率增大,则表明反应Ⅲ对
平衡转化率增大,则表明反应Ⅲ对![]() 平衡转化率的影响占主导地位,从而得出温度高于300℃,
平衡转化率的影响占主导地位,从而得出温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是反应Ⅲ的△H>0,温度升高使
平衡转化率随温度升高而上升的原因是反应Ⅲ的△H>0,温度升高使![]() 转化为
转化为![]() 的平衡转化率上升,反应Ⅳ的
的平衡转化率上升,反应Ⅳ的![]() ,温度升高使
,温度升高使![]() 转化为
转化为![]() 的平衡转化率下降:且上升幅度超过下降幅度。答案为:反应Ⅲ的△H>0,温度升高使
的平衡转化率下降:且上升幅度超过下降幅度。答案为:反应Ⅲ的△H>0,温度升高使![]() 转化为
转化为![]() 的平衡转化率上升,反应Ⅳ的
的平衡转化率上升,反应Ⅳ的![]() ,温度升高使
,温度升高使![]() 转化为
转化为![]() 的平衡转化率下降:且上升幅度超过下降幅度;
的平衡转化率下降:且上升幅度超过下降幅度;
②反应Ⅲ的反应前后气体分子数相等,而反应后气体的分子数减小,要想提高![]() 选择性,即设法促进反应Ⅳ的平衡正向移动,从而得出不改变反应时间和温度,一定能提高
选择性,即设法促进反应Ⅳ的平衡正向移动,从而得出不改变反应时间和温度,一定能提高![]() 选择性的措施有增大压强、使用对反应Ⅳ催化活性更高的催化剂。答案为:增大压强、使用对反应Ⅳ催化活性更高的催化剂;
选择性的措施有增大压强、使用对反应Ⅳ催化活性更高的催化剂。答案为:增大压强、使用对反应Ⅳ催化活性更高的催化剂;
(3)①前![]() 时,混合气的总压强为8.4MPa,设正丁烷的变化量为x,则三段式为:
时,混合气的总压强为8.4MPa,设正丁烷的变化量为x,则三段式为:

5MPa-x+x+x=8.4MPa,x=3.4MPa,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]()
![]() 0.17
0.17![]() 。
。
平衡时,混合气的总压强为8.8MPa,设正丁烷的变化量为y,则三段式为:

5MPa-y+y+y=8.8MPa,y=3.8MPa,该温度下,正丁烷的平衡转化率![]()
![]() =76%。答案为:0.17;76%;
=76%。答案为:0.17;76%;
②若平衡时乙烯的体积分数为![]() ,则平衡时p(C2H4)= p(C2H6)=8.8MPa×
,则平衡时p(C2H4)= p(C2H6)=8.8MPa×![]() =2.2MPa,发生反应后,压强由5MPa变为8.8MPa,压强增大3.8MPa,发生反应Ⅵ,压强增大2.2MPa,则发生反应Ⅴ,压强增大3.8MPa-2.2MPa=1.6MPa,从而得出平衡时p(CH4)= p(C3H6)= 1.6MPa,p(C4H10)= 5MPa-3.8MPa=1.2MPa,该温度下反应Ⅴ的分压平衡常数Kp=
=2.2MPa,发生反应后,压强由5MPa变为8.8MPa,压强增大3.8MPa,发生反应Ⅵ,压强增大2.2MPa,则发生反应Ⅴ,压强增大3.8MPa-2.2MPa=1.6MPa,从而得出平衡时p(CH4)= p(C3H6)= 1.6MPa,p(C4H10)= 5MPa-3.8MPa=1.2MPa,该温度下反应Ⅴ的分压平衡常数Kp=![]() = 2.1MPa。答案为:2.1;
= 2.1MPa。答案为:2.1;
③反应在恒温、恒压条件下进行,若平衡不移动,则平衡后反应容器的体积为8.8L,现减压导致平衡向气体分子数增大的方向移动,气体的压强增大,所以还需增大容器的体积,以保证压强不变,从而得出平衡后反应容器的体积大于![]() 。答案为:大于。
。答案为:大于。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案