题目内容
【题目】现有①氯化钡、②金刚石、③氯化铵、④硫酸钠、⑤干冰、⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,以分子间作用力结合的是________。
(3)①的电子式是____________,⑥的电子式是____________。
【答案】⑤⑥ ② ② ⑤ ①③④ ① ⑤⑥ [C]-Ba2+[C]-
【解析】
(1)BaCl2属于离子晶体,金刚石属于原子晶体,NH4Cl、Na2SO4属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,分子晶体熔化时不需要破坏化学键,原子晶体、离子晶体熔化时需要破坏化学键;一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高;
(2)BaCl2、NH4Cl、Na2SO4属于离子化合物,BaCl2只含有离子键,分子晶体以分子间作用力结合;
(3)BaCl2为离子化合物,存在离子键;碘为非金属单质,以共用电子对成键。
(1)BaCl2属于离子晶体,金刚石属于原子晶体,NH4Cl、Na2SO4属于离子晶体,干冰属于分子晶体,碘晶体属于分子晶体,熔化时不需要破坏化学键的是干冰、碘晶体,熔化时需要破坏共价键的是金刚石,BaCl2、NH4Cl、Na2SO4熔化时破坏离子键,一般物质熔点:原子晶体>离子晶体>分子晶体,分子晶体中相对分子质量越大,分子间作用力越强,物质的熔点越高,故熔点最高的是金刚石,熔点最低的是干冰,故熔化时不需要破坏化学键的是⑤⑥,熔化时需要破坏共价键的是②,熔点最高的是②,熔点最低的是⑤;
(2)BaCl2、NH4Cl、Na2SO4属于离子化合物,NH4Cl含有离子键、共价键,而BaCl2只含有离子键,干冰、碘晶体以分子间作用力结合;
(3)BaCl2为离子化合物,其电子式为[C]-Ba2+[C]-;碘为非金属单质,以共用电子对成键,则电子式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:![]() △H1 平衡常数为K1
△H1 平衡常数为K1
反应Ⅱ:![]() △H2 平衡常数为K2
△H2 平衡常数为K2
不同温度下,K1、K2的值如下表:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() ,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
(2)![]() 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种![]() 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅲ:![]() △H3
△H3
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
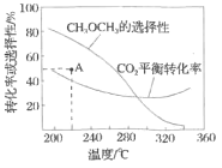
平衡转化率和平衡时![]() 的选择性随温度的变化如图。
的选择性随温度的变化如图。
其中:![]() 的选择性
的选择性![]()
①温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是________。
平衡转化率随温度升高而上升的原因是________。
②220℃时,在催化剂作用下![]() 与
与![]() 反应一段时间后,测得
反应一段时间后,测得![]() 的选择性为48%(图中
的选择性为48%(图中![]() 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高![]() 选择性的措施有________。
选择性的措施有________。
(3)石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应Ⅴ:![]()
反应Ⅵ:![]()
一定温度下,向容积为![]() 的密闭容器中通入正丁烷,反应时间
的密闭容器中通入正丁烷,反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 数据如下:
数据如下:
| 0 | 10 | 20 | 30 | 40 |
| 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①反应速率可以用单位时间内分压的变化表示,即v=![]() ,前
,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]() ________
________![]() ,该温度下,正丁烷的平衡转化率
,该温度下,正丁烷的平衡转化率![]() ________。
________。
②若平衡时乙烯的体积分数为![]() ,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
③若反应在恒温、恒压条件下进行,平衡后反应容器的体积________![]() (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。