题目内容
某电化学装置如图,下列说法正确的是( )
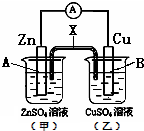

| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会增加 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.若X是盐桥,则该装置是原电池,Zn是负极、Cu是正极,电子从负极流向正极;
B.若X是铜条,左边甲形成原电池,发生吸氧腐蚀;
C.若X是石墨条,甲为锌的吸氧腐蚀,乙为电解池,电解硫酸铜会产生硫酸;
D.若X是锌条,右边乙形成原电池,发生吸氧腐蚀,X为负极,Cu为正极,甲为电解池,Zn为阳极,发生氧化反应.
B.若X是铜条,左边甲形成原电池,发生吸氧腐蚀;
C.若X是石墨条,甲为锌的吸氧腐蚀,乙为电解池,电解硫酸铜会产生硫酸;
D.若X是锌条,右边乙形成原电池,发生吸氧腐蚀,X为负极,Cu为正极,甲为电解池,Zn为阳极,发生氧化反应.
解答:
解:A.若X是盐桥,则该装置是原电池,Zn是负极、Cu是正极,电子从负极A(锌)沿导线流向正极B(铜),故A错误;
B.若X是铜条,左边甲形成原电池,发生吸氧腐蚀,A电极的电极反应式是Zn-2e-═Zn2+,故B错误;
C.若X是石墨条,甲为锌的吸氧腐蚀,乙为电解池,电解硫酸铜会产生硫酸,则乙池溶液的pH会减小,故C正确;
D.若X是锌条,右边乙形成原电池,发生吸氧腐蚀,X为负极,Cu为正极,甲为电解池,Zn为阳极,发生氧化反应,质量会减小,故D错误;
故选C.
B.若X是铜条,左边甲形成原电池,发生吸氧腐蚀,A电极的电极反应式是Zn-2e-═Zn2+,故B错误;
C.若X是石墨条,甲为锌的吸氧腐蚀,乙为电解池,电解硫酸铜会产生硫酸,则乙池溶液的pH会减小,故C正确;
D.若X是锌条,右边乙形成原电池,发生吸氧腐蚀,X为负极,Cu为正极,甲为电解池,Zn为阳极,发生氧化反应,质量会减小,故D错误;
故选C.
点评:本题考查了原电池原理,明确盐桥的作用是解本题关键,将盐桥变为其它金属或导电的非金属不能构成原电池,再结合是否能自发进行氧化还原反应分析解答,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50mLbmol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法不正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中不一定含有Fe3+ |
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
下列用品的有效成分正确的是( )
A、 KAl(SO4)2?12H2O |
B、 Na2CO3 |
C、 C6H12O6 |
D、 NaClO |
0.1mol两种气态烃组成的混合气体完全燃烧,得到0.16molCO2和3.6g水.下列说法不正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中可能有乙炔 |
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是( )
| A、将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量少 |
| B、盐酸可与醋酸钠溶液反应生成醋酸 |
| C、相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
| D、等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大 |
以下实验能获得成功的是( )
| A、要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
| B、用氨水清洗试管壁附着的银镜 |
| C、对苯和硝基苯采用分液的方法分离 |
| D、将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
已知热化学方程式C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是( )
| A、乙炔的燃烧热为1256kJ/mol |
| B、若生成2mol 液态水,则放出的热量小于2512kJ |
| C、若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
| D、若转移10mol电子,则消耗2.5molO2 |
对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是( )
| A、SO32-、OH-、Cl-、K+ |
| B、Na+、NO3-、OH-、Cl- |
| C、K+、Na+、NO3-、Cl- |
| D、K+、CO32-、H+、Ba2+ |