题目内容
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50mLbmol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法不正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中不一定含有Fe3+ |
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:A.溶液中有硝酸根时,再加入酸,溶液具有强氧化性,金属能溶解;
B.金属全部溶解,Fe可能以Fe2+形式存在;
C.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据N元素守恒计算起氧化剂作用的硝酸的浓度,据此判断;
D.反应中失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,得失电子数目相同.
B.金属全部溶解,Fe可能以Fe2+形式存在;
C.若金属全部溶解,失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,反应中硝酸起氧化剂、酸性作用,根据N元素守恒计算起氧化剂作用的硝酸的浓度,据此判断;
D.反应中失去电子的是铁元素和铜元素,得电子的是硝酸中的氮元素,得失电子数目相同.
解答:
解:A.若金属有剩余,说明溶液中有硝酸根,在溶液中再滴入硫酸后,相当于又存在了硝酸,金属均能溶解,故A正确;
B.当铁的量较多时,可以将生成的三价铁再还原为亚铁,溶液中不一定含有Fe3+,故B正确;
C.硝酸中N元素的化合价由+5价到+2价,当产生336mL(标准状况),即0.015mol一氧化氮时,显示氧化性的硝酸为0.015mol,所以起氧化剂的硝酸的浓度c=
=0.3mol/L,还有一部分硝酸显示了酸性,即b>0.3,故C错误;
D.根据铁和铜与硝酸的反应,作酸性的硝酸在Fe(NO3)3和Cu(NO3)2中,为3y(1-a)+2yamol,作氧化性的硝酸,得到的电子等于Fe、Cu失去的电子,由于NO是唯一的还原产物,所以作氧化性的硝酸为
mol,所有硝酸的总量为
=4y(1-
),c(HNO3)=
=80y(1-
),因为硝酸还可能有剩余,所以b≥80y(1-
),故D正确.
故选:C.
B.当铁的量较多时,可以将生成的三价铁再还原为亚铁,溶液中不一定含有Fe3+,故B正确;
C.硝酸中N元素的化合价由+5价到+2价,当产生336mL(标准状况),即0.015mol一氧化氮时,显示氧化性的硝酸为0.015mol,所以起氧化剂的硝酸的浓度c=
| 0.015mol |
| 0.05L |
D.根据铁和铜与硝酸的反应,作酸性的硝酸在Fe(NO3)3和Cu(NO3)2中,为3y(1-a)+2yamol,作氧化性的硝酸,得到的电子等于Fe、Cu失去的电子,由于NO是唯一的还原产物,所以作氧化性的硝酸为
| 3y(1-a)+2ya |
| 3 |
| 4[3y(1-a)+2ya] |
| 3 |
| a |
| 3 |
4y(1-
| ||
| 0.05L |
| a |
| 3 |
| a |
| 3 |
故选:C.
点评:本题考查氧化还原反应的计算,题目难度中等,注意物质氧化性、还原性的比较,结合质量守恒和得失电子守恒计算.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
标准状况下,向1L1.0mol/LNaOH溶液中通入17.92LCO2,充分反应后溶液中的CO32-,HCO3-的物质的量浓度之比为( )
| A、2:1 | B、1:2 |
| C、1:3 | D、1:4 |
下列实验装置所对应的实验方案正确且能达到相应实验预期目的是( )
A、 装置可证明铁生锈时空气参与反应 |
B、 装置可除去乙烯中混有的少量SO2 |
C、 装置可用于分离沸点不同且互溶的液体混合物 |
D、 装置可用铜和浓硝酸反应制取少量NO2 |
某电化学装置如图,下列说法正确的是( )
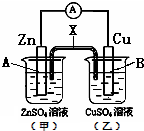

| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会增加 |
可促进HClO的电离,并使pH增大的是( )
①加入HCl ②加入NaClO ③加入NaOH ④加入Zn.
①加入HCl ②加入NaClO ③加入NaOH ④加入Zn.
| A、①②③④ | B、②③④ |
| C、③④ | D、②④ |
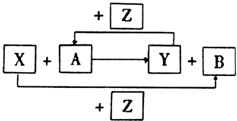 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)