题目内容
已知热化学方程式C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是( )
| A、乙炔的燃烧热为1256kJ/mol |
| B、若生成2mol 液态水,则放出的热量小于2512kJ |
| C、若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
| D、若转移10mol电子,则消耗2.5molO2 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、气态水变为液态水放热;
C、形成4mol碳氧共用电子对是形成1mol二氧化碳;
D、依据氧化还原反应电子守恒计算分析计算.
B、气态水变为液态水放热;
C、形成4mol碳氧共用电子对是形成1mol二氧化碳;
D、依据氧化还原反应电子守恒计算分析计算.
解答:
解:A、热化学方程式中水是气体不是稳定的氧化物,所以燃烧热应大于1256kJ/mol,故A错误;
B、气态水变为液态水放热,若生成2mol液态水,则△H<-2512kJ/mol,放热大于2512kJ,故B错误;
C、若形成4mol碳氧共用电子对,化学方程式中生成1mol二氧化碳,则放出的热量为628kJ,故C错误;
D、依据反应化学方程式可知,电子转移为10mol,消耗2.5mol氧气,故D正确;
故选D.
B、气态水变为液态水放热,若生成2mol液态水,则△H<-2512kJ/mol,放热大于2512kJ,故B错误;
C、若形成4mol碳氧共用电子对,化学方程式中生成1mol二氧化碳,则放出的热量为628kJ,故C错误;
D、依据反应化学方程式可知,电子转移为10mol,消耗2.5mol氧气,故D正确;
故选D.
点评:本题考查了燃烧热的概念分析判断,氧化还原反应的电子转移计算应用,盖斯定律的应用,题目难度中等.

练习册系列答案
相关题目
某电化学装置如图,下列说法正确的是( )
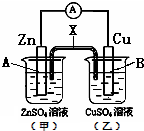

| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会增加 |
下列反应中,属于取代反应的是( )
A、CH2=CH2+HCl
| |||
B、CH4+Cl2
| |||
C、2CH3CHO+O2
| |||
D、CH3CH2Br+NaOH
|
戊烷的二氯代物有10种同分异构体,则其十氯代物的同分异构体的数目为( )
| A、8种 | B、9种 |
| C、10种 | D、11种 |
分子式为C5H10O2的同分异构体甚多,其中符合下列条件的同分异构体共有(不考虑立体异构)①能发生银镜反应; ②能与金属钠或能发生水解反应( )
| A、12种 | B、13种 |
| C、16种 | D、18种 |
可促进HClO的电离,并使pH增大的是( )
①加入HCl ②加入NaClO ③加入NaOH ④加入Zn.
①加入HCl ②加入NaClO ③加入NaOH ④加入Zn.
| A、①②③④ | B、②③④ |
| C、③④ | D、②④ |
 如图是298K 时N2与H2反应过程中能量变化的曲线图.下列叙述不正确的是( )
如图是298K 时N2与H2反应过程中能量变化的曲线图.下列叙述不正确的是( )| A、该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1 |
| B、b曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的活化能和反应热都改变 |
| D、在温度体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2>2Q1 |
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,反应中,1molCu2+能氧化P的物质的量是( )
A、
| ||
B、
| ||
C、
| ||
D、
|