题目内容
0.1mol两种气态烃组成的混合气体完全燃烧,得到0.16molCO2和3.6g水.下列说法不正确的是( )
| A、混合气体中一定有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中可能有乙炔 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:生成水的物质的量为:n(H2O)=
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而碳原子数小于1.6的只有甲烷,则一定含有甲烷,然后根据平均分子式进行判断.
| 3.6g |
| 18g/mol |
解答:
解:n(H2O)=
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,混合烃的平均分子式为C1.6H4;
烃中C原子数小于1.6的只有CH4,则混合气体中一定含有CH4,由于CH4分子中含4个H原子,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是C2H4或C3H4,
A.根据以上分析可知,混合气体中一定含有CH4,故A正确;
B.混合气体中一定含有CH4,可能含有C2H4,即不一定含有乙烯,故B错误;
C.由于氢原子平均为4,则混和气体中一定没有C2H6,故C正确;
D.混合烃的平均分子式为:C1.6H4,烃中C原子数小于1.6的只有CH4,则一定含有CH4,CH4分子中含4个H原子,故另一种分子中一定含4个H原子,则一定没有乙炔,故D错误;
故选BD.
| 3.6g |
| 18g/mol |
烃中C原子数小于1.6的只有CH4,则混合气体中一定含有CH4,由于CH4分子中含4个H原子,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是C2H4或C3H4,
A.根据以上分析可知,混合气体中一定含有CH4,故A正确;
B.混合气体中一定含有CH4,可能含有C2H4,即不一定含有乙烯,故B错误;
C.由于氢原子平均为4,则混和气体中一定没有C2H6,故C正确;
D.混合烃的平均分子式为:C1.6H4,烃中C原子数小于1.6的只有CH4,则一定含有CH4,CH4分子中含4个H原子,故另一种分子中一定含4个H原子,则一定没有乙炔,故D错误;
故选BD.
点评:本题考查混合烃组成的判断,题目难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列实验装置所对应的实验方案正确且能达到相应实验预期目的是( )
A、 装置可证明铁生锈时空气参与反应 |
B、 装置可除去乙烯中混有的少量SO2 |
C、 装置可用于分离沸点不同且互溶的液体混合物 |
D、 装置可用铜和浓硝酸反应制取少量NO2 |
 某同学按如图所示的装置进行电解实验.下列说法正确的是( )
某同学按如图所示的装置进行电解实验.下列说法正确的是( )| A、电解过程中,铜电极上有H2产生 | ||||
| B、电解一定时间后,石墨电极不可能有铜析出 | ||||
C、电解初期,主反应方程式为:Cu+H2SO4
| ||||
| D、整个电解过程中,H+的浓度不断增大 |
某电化学装置如图,下列说法正确的是( )
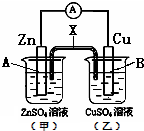

| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会增加 |
在0.1mol/L的醋酸溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列说法正确的是( )
A、加入水稀释
| ||
| B、加水稀释,醋酸的电离度虽然增大,但溶液中各种离子的浓度均减小 | ||
| C、因为醋酸钠水解显碱性,故加入少量的醋酸钠固体,平衡向电离方向移动 | ||
| D、该溶液pH增大时,CH3COO-浓度也增大 |
戊烷的二氯代物有10种同分异构体,则其十氯代物的同分异构体的数目为( )
| A、8种 | B、9种 |
| C、10种 | D、11种 |
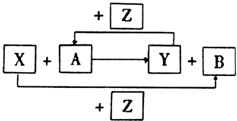 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)