题目内容
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A、电解熔融氢氧化钠制钠,阳极发生电极反应为:4OH--4e-=O2↑+2H2O |
| B、盖?吕萨克法制钠原理是利用铁的还原性比钠强 |
| C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阴极,铁为阳极 |
考点:电解原理
专题:电化学专题
分析:A.阳极氢氧根离子放电生成氧气和水;
B.1100℃时生成Na蒸气,有利于反应正向移动;
C.戴维法生成4molNa转移4mol电子,但盖?吕萨克法生成4molNa转移8mol电子;
D.石墨极为阳极,氯离子放电,在阴极钠离子放电.
B.1100℃时生成Na蒸气,有利于反应正向移动;
C.戴维法生成4molNa转移4mol电子,但盖?吕萨克法生成4molNa转移8mol电子;
D.石墨极为阳极,氯离子放电,在阴极钠离子放电.
解答:
解:A.由4NaOH(熔)
4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A正确;
B.1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;
C.由4NaOH(熔)
4Na+O2↑+2H2O、3Fe+4NaOH
Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖?吕萨克法生成4molNa转移8mol电子,则转移电子不等,故C错误;
D.电解熔融氯化钠法制钠时,石墨极为阳极,氯离子放电,在阴极钠离子放电,发生2NaCl
2Na+Cl2↑,故D错误;
故选A.
| ||
B.1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;
C.由4NaOH(熔)
| ||
| ||
D.电解熔融氯化钠法制钠时,石墨极为阳极,氯离子放电,在阴极钠离子放电,发生2NaCl
| ||
故选A.
点评:本题考查金属的冶炼及电解原理,明确元素的化合价变化及发生的电极反应即可解答,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列表示物质结构的化学用语或模型正确的是( )
A、NaCl的电子式: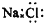 |
| B、乙烯的结构式:CH2=CH2 |
C、S2-结构示意图: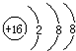 |
D、CH4分子的球棍模型: |
根据柠檬醛的结构简式: ,判断下列有关说法中不正确的是( )
,判断下列有关说法中不正确的是( )
 ,判断下列有关说法中不正确的是( )
,判断下列有关说法中不正确的是( )| A、它可以使酸性高锰酸钾溶液褪色 |
| B、它可以使溴水褪色 |
| C、它与银氨溶液发生反应生成银镜 |
| D、它的催化加氢反应产物的分子式为C10H20O |
下列物质不能以食盐为原料而生产的是( )
| A、盐酸 | B、硫酸 | C、烧碱 | D、纯碱 |
下列对元素周期表说法不正确的是( )
| A、在金属和非金属的分界线附近可以找到半导体材料 |
| B、第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性 |
| C、如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置 |
| D、目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质 |
 如图是某烷分子的球棍模型图,图中大、小“球”表示两种元素的原子,“棍”表示化学键.其结构简式是( )
如图是某烷分子的球棍模型图,图中大、小“球”表示两种元素的原子,“棍”表示化学键.其结构简式是( )| A、CH3CH3 |
| B、CH3CH2CH3 |
| C、CH3CH2CH2CH3 |
| D、CH2CH3CH4 |
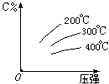 可逆反应mA (g)+nB(s)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA (g)+nB(s)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A、达平衡后,加入催化剂,加快反应速率,使C%增大 |
| B、达平衡后,增加B的量有利于平衡向正反应方向移动 |
| C、化学方程式中m+n<e+f |
| D、该可逆反应的正反应的△H<0 |
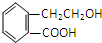 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.