题目内容
14.在一定条件下可实现如图所示物质之间的变化: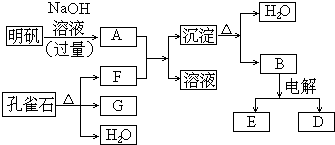
请填写以下空白:
(1)孔雀石的主要成分是CuCO3•Cu(OH)2(碱式碳酸铜),写出其受热分解的反应方程式CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O↑.
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:Al3++4OH-═AlO2-+2H2O.
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:3CuO+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu .
(4)写出A和足量F反应的化学方程式AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
(5)写出B电解的反应方程式2Al2O3 $\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,当有22.4L(S.T.P)E生成时,电子转移的数目是4NA个.
分析 明矾主要成分为KAl(SO4)2,能够电离出Al3+,与过量NaOH溶液反应生成偏铝酸钠,孔雀石受热分解生成氧化铜、二氧化碳和水,产物二氧化碳能够和偏铝酸钠反应生成沉淀氢氧化铝,氢氧化铝受热分解生成氧化铝,工业冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.所以A为NaAlO2,B为Al2O3,F为CO2,G和D都是固体,D为Al,G为CuO,E为O2,以此来解答.
解答 解:明矾主要成分为KAl(SO4)2,能够电离出Al3+,与过量NaOH溶液反应生成偏铝酸钠,孔雀石受热分解生成氧化铜、二氧化碳和水,产物二氧化碳能够和偏铝酸钠反应生成沉淀氢氧化铝,氢氧化铝受热分解生成氧化铝,工业冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.所以A为NaAlO2,B为Al2O3,F为CO2,G和D都是固体,D为Al,G为CuO,E为O2,
(1)CuCO3•Cu(OH)2分解生成CuO、水和二氧化碳,方程式为CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2 CuO+CO2↑+H2O↑,
故答案为:CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2 CuO+CO2↑+H2O↑;
(2)明矾与过量NaOH溶液反应生成偏铝酸钾、硫酸钠和水,所以其反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)氢氧化铝能分解生成水和氧化铝,故B可为氧化铝,氧化铝能分解为铝和水,D为固体,则D可能为铝,G为CuO,混和后在高温下可发生反应,铝能与氧化铜反应生成氧化铜和铝,3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu,
故答案为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu;
(4)A与足量F反应的离子方程式为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(5)B为Al2O3,氧化铝电解能生成铝和氧气,其反应的化学方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,由Al2O3电解反应可知,每生成3mol氧气,电子转移12mol,22.4L(S.T.P)氧气生成时物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,电子转移的数目是4NA,
故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;4NA.
点评 本题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据叙述的关键,以及物质的性质和物质之间的反应做出判断,题目难度中等,

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数 |
| A. | Na2O2与水反应:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
| A. | 含等物质的量的HNO3、Na2CO3、CH3COOH的溶液 | |
| B. | pH=1的盐酸与pH=13的氨水等体积混合 | |
| C. | 0.05mol/L的H2SO4和0.1mol/L的KOH等体积混合 | |
| D. | pH=2的CH3COOH和pH=12的NaOH等体积混合 |
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、S2O32-、NO3- | ||
| C. | Al3+、Fe3+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、AlO2- |
 ⑨淀粉和纤维素
⑨淀粉和纤维素