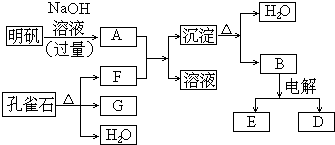
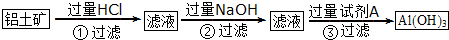题目内容
5.下列表示化学反应的离子方程式正确的是( )| A. | Na2O2与水反应:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
分析 A.得失电子不守恒;
B.惰性电极电解MgCl2溶液生成氢氧化镁沉淀;
C.酸性条件下,双氧水与亚铁离子反应生成铁离子和水;
D.加入过量的NaHSO4溶液至中性,以1:2反应,生成硫酸钡、硫酸钠和水.
解答 解:A.Na2O2与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑,故A错误;
B.惰性电极电解MgCl2溶液生成氢氧化镁沉淀,则离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2+H2↑+Cl2↑,故B错误;
C.酸性条件下,双氧水与亚铁离子反应生成铁离子和水,则离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故C正确;
D.加入过量的NaHSO4溶液至中性,以1:2反应,生成硫酸钡、硫酸钠和水,其反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误.
故选C.
点评 本题考查离子反应方程式书写,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
20.下列除杂所用试剂或操作均合理的是( )
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 苯(苯酚) | 溴水 | 分液 |
| C | Fe2O3(Al2O3) | 氨水 | 过滤 |
| D | Cl2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
10.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为24.X的原子半径比Y大,Y与Z同主族,Y原子的最外层电子数是电子层数的3倍,下列说法正确的是( )
| A. | Y元素形成的单核阴离子还原性强于X元素形成的单核阴离子还原性 | |
| B. | Z元素的简单气态氢化物的沸点比Y的氢化物沸点高 | |
| C. | W元素氧化物对应水化物的酸性一定强于Z元素氧化物对应水化物的酸性 | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
17.某有机物的分子式为C9H10O3.它有多种同分异构体,同时符合下列四个条件的同分异构体有( )
①能与Na2CO3溶液反应,但是不能生成气体;
②苯环上的一氯代物只有两种;
③能发生水解反应;
④该有机物是苯的二取代物.
①能与Na2CO3溶液反应,但是不能生成气体;
②苯环上的一氯代物只有两种;
③能发生水解反应;
④该有机物是苯的二取代物.
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
15.如图是硝酸钾的溶解度曲线,下列说法错误的是( )


| A. | 硝酸钾的溶解度随温度的升高而增大 | |
| B. | 降低温度可以使接近饱和的硝酸钾溶液变饱和 | |
| C. | 60℃时120g硝酸钾与100g水充分混合可以形成饱和溶液 | |
| D. | 60℃时硝酸钾溶液中溶质质量分数一定大于30℃时硝酸钾溶液中溶质质量分数 |
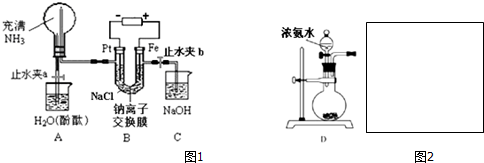
 .
. .
. ,元素D在元素周期表中的位置是第三周期VIIA族.
,元素D在元素周期表中的位置是第三周期VIIA族.