题目内容
9.我国对中药中重金属元素和有毒元素的含量等各项指标检查是非常严格的.下面是分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
②将待测溶液转移到250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③用0.001mol/L标准碘溶液滴定待测溶液至终点,消耗20.00mL标准I2溶液,发生的反应为:H3AsO3+I2+H2O→H3AsO4+I-+H+(未配平)
试回答下列问题:
(1)简述如何对中草药样品进行前期处理制得待测溶液?取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液.
(2)配平离子反应方程式:1H3AsO3+1I2+1H2O-1H3AsO4+2I-+2H+
(3)如何判断滴定到达终点?溶液由无色变为蓝色,保持半分钟不变色.
(4)我国《药用植物及制剂进出口绿色行业标准》中规定:绿色中药的砷含量不能超过2.000mg/kg,试计算该草药样品中砷含量为1.5mg/kg,则该草药样品合格(填“合格”或“不合格”).
分析 (1)类似于海带中碘的提取与检验:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液;
(2)反应中H3AsO3→H3AsO4,As元素化合价由+3价升高为+5价,共升高2价.I2→I-,I元素的化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为2,故H3AsO3的系数为1,I2的系数为1,再结合原子守恒、电荷守恒配平其它物质系数;
(3)淀粉在与碘有关的氧化还原滴定中常用作指示剂,用0.001mol/L标准碘溶液滴定待测溶液至终点,故颜色变化为由无色变为蓝色,且要半分钟不变色;
(4)由多步反应得:As~I2,据此计算1kg药品中As元素的质量,据此计算判断.
解答 解:(1)类似于海带中碘的提取与检验,将样品灼烧后在蒸馏水中溶解使有效成分溶解.利用过滤得到所需待测溶液,操作步骤为:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液,
故答案为:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液;
(2)反应中H3AsO3→H3AsO4,As元素化合价由+3价升高为+5价,共升高2价.I2→I-,I元素的化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为2,故H3AsO3的系数为1,I2的系数为1,再结合原子守恒、电荷守恒配平其它物质系数,配平后方程式为:H3AsO3+I2+H2O=H3AsO4+2I-+2H+,
故答案为:1;1;1;1;2;2;
(3)淀粉在与碘有关的氧化还原滴定中常用作指示剂,用0.001mol/L标准碘溶液滴定待测溶液至终点,故颜色变化为由无色变为蓝色,且要半分钟不变色,
故答案为:溶液由无色变为蓝色,保持半分钟不变色;
(4)由多步反应得:As~I2,
75 1
m 0.001mol/L×0.020L
解得m(As)=0.0015g,
则含量为:0.0015×$\frac{1000mg}{1kg}$=1.5mg/kg<2.000mg/kg,故合格,
故答案为:1.5;合格.
点评 本题考查物质含量的测定,为高频考点,涉及氧化还原反应、滴定及离子反应、关系式的计算等,侧重分析与计算能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 苯(苯酚) | 溴水 | 分液 |
| C | Fe2O3(Al2O3) | 氨水 | 过滤 |
| D | Cl2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
①能与Na2CO3溶液反应,但是不能生成气体;
②苯环上的一氯代物只有两种;
③能发生水解反应;
④该有机物是苯的二取代物.
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 空气中电子式为  的分子含量过多会造成温室效应 的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为 和 和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
| A. | 高纯度的硅晶体广泛用于制造光导纤维材料 | |
| B. | 燃烧化石燃料产生的废气中含有 SO2,会造成大气污染,使雨水 pH=5.6形成酸雨 | |
| C. | “春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃 | |
| D. | 海轮外壳上镶入铜块,可以延缓船体腐蚀 |
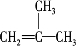 .
.

 .
.