题目内容
20.有关“人工固氮”研究的最新报道:在常温、常压、光照条件下,N2可在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:2N2(g)+6H2O(l)═4NH3(g)+3O2(g).已知:①N2(g)+3H2(g)?2NH3(g)△H1=-92.0kJ/mol
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ/mol
请回答:
(1)反应①属于放热(填“吸热”或“放热”)反应.
(2)反应①消耗3mol H2(g)时,△H=-92kJ/mol.
(3)反应②生成1mol O2(g)时,△H=+571.6 kJ/mol.
(4)反应2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.8kJ/mol.
分析 (1)△H小于0的反应为放热反应;
(2)根据反应①的热化学方程式可知,当3mol氢气消耗时,反应的△H=-92.0kJ/mol;
(3)根据反应②的热化学方程式可知,当1mol氧气生成时,反应热△H=+571.6kJ/mol;
(4)根据盖斯定律来分析.
解答 解:(1)反应①的反应热为负值,而△H小于0的反应为放热反应,故反应①为放热反应,故答案为:放热;
(2)根据反应①的热化学方程式可知,1mol氮气和3mol氢气完全反应时,放热92KJ,即当3mol氢气消耗时,反应的△H=-92.0kJ/mol,故答案为:-92;
(3)根据反应②的热化学方程式可知,当2mol液态水分解为2mol氢气和1mol氧气时,吸热571.6KJ,故当1mol氧气生成时,反应热△H=+571.6kJ/mol,故答案为:+571.6;
(4)根据盖斯定律可知,将①×2+②×3可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(-92.0kJ/mol)×2+(+571.6kJ/mol)×3=+1530.8KJ/mol,故答案为:+1530.8KJ/mol.
点评 本题考查了反应热的计算和盖斯定律的应用,难度不大,应注意基础的掌握.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
10.除去溶解在苯中的少量苯酚,正确的方法是( )
| A. | 过滤 | B. | 用分液漏斗分液 | ||
| C. | 通入足量CO2后,过滤 | D. | 加入适量NaOH溶液,反应后再分液 |
11.位于周期表第ⅦA族的元素是( )
| A. | H | B. | Mg | C. | O | D. | F |
8.下列解释实验事实的离子方程式正确的是( )
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
5.钠与水反应时的现象中与钠的下列性质无关的是( )
| A. | 钠的熔点低 | B. | 钠的密度小 | C. | 钠的硬度小 | D. | 有强还原性 |
12. 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
(1)该图中有两处仪器未画出,它们是泡沫塑料板(硬纸板)、环形玻璃搅拌棒.
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2,中和后生成溶液的比热容c=4.08J/(g•℃).则中和热△H=-52.2kJ/mol(取小数点后一位).
(4)有关中和热测定实验,下列说法错误的是bc
a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:(1)该图中有两处仪器未画出,它们是泡沫塑料板(硬纸板)、环形玻璃搅拌棒.
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
(4)有关中和热测定实验,下列说法错误的是bc
a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
9.下列与化学概念有关的说法正确的是( )
| A. | 化合反应均为氧化还原反应 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| D. | 摩尔是七个基本物理量之一 |
10.如图是工业海水提溴的部分流程,下列有关说法正确的是( )

| A. | “吹出”采用热空气而不是常温空气的原因是热空气氧化性强 | |
| B. | 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5 | |
| C. | 第③步中“酸化”要用强氧化性的酸,如硝酸 | |
| D. | 含溴的水溶液B中的单质溴浓度比A中的大 |
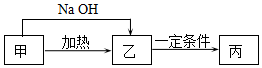 甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.
甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.