题目内容
12.近年来我省围绕“资源节约型和环境友好型”这一主题,积极谋求社会的和谐发展.请根据这一主题和题意,用下列选项的标号进行填空.A.二氧化碳 B.含磷洗衣粉 C.二氧化硫
(1)推广使用燃煤脱硫技术,防治C造成的污染.
(2)造成温室效应和全球气候变暖的主要物质是A.
(3)导致水体富营养化的物质是B.
分析 (1)煤中含有硫元素,煤燃烧会产生大量的二氧化硫,造成空气污染;
(2)二氧化碳的大量排放会导致全球气候变暖,引起温室效应;
(3)氮和磷为植物生长的营养剂,大量排入水域后会导致水体富营养化污染.
解答 解:(1)煤中含有硫元素,煤燃烧会产生大量的二氧化硫,推广使用燃煤脱硫技术,可以防治二氧化硫造成的空气污染,故选C,
故答案为:C;
(2)造成温室效应和全球气候变暖的主要物质是二氧化碳气体,故选A,
故答案为:A;
(3)含氮、磷的化合物排放到水中会使水体出现富营养化,使某些藻类迅速繁殖,从而造成水体缺氧,使其他水生生物因缺氧而死亡,破坏生态系统,故B正确,
故答案为:B.
点评 本题考查了生活中常见的污染和治理,为高频考点,题目难度不大,试题侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意对相关内容的积累.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
| 选项 | 物质 | 选用的试剂 | 操作方法 |
| ① | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| ② | CO2(CO) | 氧气 | 点燃 |
| ③ | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| ④ | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
3.下列离子方程式与所述事实相符且正确的是( )
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
20.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
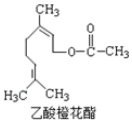

| A. | 分子式为 C12H22O2 | |
| B. | 1mol 该有机物水解时只能消耗 1 mol NaOH | |
| C. | 能使酸性 KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| D. | 1mol 该有机物在一定条件下和 H2反应,共消耗 H2 为 3mol |
7.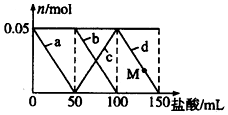 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |
17.某化学反应 3A?2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
4.下列说法中正确的是( )
| A. | 1mol任何物质都含有6.02×1023个分子 | |
| B. | 在相同条件下,相同物质的量CO、N2的混合气体与O2的分子个数相同,原子个数也相同 | |
| C. | NaOH的摩尔质量40g | |
| D. | 在标准状况下,1molO2与1molSO3的体积相同 |
1.下列离子方程式书写正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
2.锂离子电池的应用很广,一种利用钛铁矿[主要成分为偏钛酸亚铁(FeTiO3),含有少量Fe2O3]制取钛白粉(TiO2)和利用其副产物制取锂离子电池的正极材料(LiFePO4)的工艺流程如图(部分条件未给出).
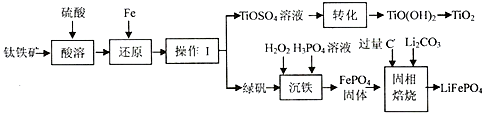
(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
则操作I 的名称为蒸发浓缩、冷却结晶、过滤.
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.

(1)FeTiO3中Ti的化合价为+4;在“还原”步骤中,还原“Fe3+”的反应中氧化剂和还原剂之比为2:1.
(2)FeSO4溶解度与温度关系如表,
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
(3)“转化”步骤中对溶液进行加热的主要目的是加快和促进水解.
(4)写出“沉铁”的离子反应方程式2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,为使Fe3+完全沉降,则PO43-的浓度至少应为9.91×10-11mol/L(己知:ksp (FePO4•2H2O)=9.91×10-16).
(5)流程中可循环利用的物质是(H2O除外)H2SO4,写出固相焙烧的反应方程式2FePO4+Li2CO3+2C$\frac{\underline{\;焙烧\;}}{\;}$2LiFePO4+3CO↑.
(6)某锂离子充放电时,正极发生LiFePO4与FePO4的转化,当充电时,电池负极发生的反应为6C+xLi++xe-=LixC6,写出放电时电池反应方程式xFePO4+LixC6=6C+xLiFePO4.