题目内容
氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式: MnO4-+ HSO3-+ H+-- Mn2++ SO42-+ H2O
(2)用KMnO4进行滴定时,KMnO4溶液应装在 中,判断滴定终点的现象是 .
(3)下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
(4)根据下表中测定的实验数据,计算KMnO4溶液体积的平均值为 mL;NaHSO3溶液的物质的量浓度为 mol/L(数据精确到0.1)
(1)配平离子方程式:
(2)用KMnO4进行滴定时,KMnO4溶液应装在
(3)下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
(4)根据下表中测定的实验数据,计算KMnO4溶液体积的平均值为
| 实验编号 | 待测NaHSO3溶液的体积/mL | KMnO4溶液的体积/mL |
| 1 | 20.00 | 15.98 |
| 2 | 20.00 | 17.00 |
| 3 | 20.00 | 16.02 |
考点:氧化还原反应方程式的配平,溶液的配制,中和滴定
专题:实验题,氧化还原反应专题
分析:(1)根据氧化还原反应中得失电子相等来配平方程式,1mol高锰酸根离子参加氧化还原反应得到5mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子;
(2)KMnO4溶液能够腐蚀橡胶,应该用酸式滴定管;滴定完成时NaHSO3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去,就说明NaHSO3溶液已完全被氧化;
(3)根据c=
判断不当操作对n或V的影响判断测定结果,
A、酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响;
C、定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大;
D、观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小;
(4)实验2中KMnO4溶液的体积的偏离较大,舍去不用,由实验1和3取KMnO4溶液体积的平均值;
根据高锰酸钾和亚硫酸氢钠之间的关系式计算亚硫酸氢钠的物质的量浓度.
(2)KMnO4溶液能够腐蚀橡胶,应该用酸式滴定管;滴定完成时NaHSO3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去,就说明NaHSO3溶液已完全被氧化;
(3)根据c=
| n |
| V |
A、酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响;
C、定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大;
D、观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小;
(4)实验2中KMnO4溶液的体积的偏离较大,舍去不用,由实验1和3取KMnO4溶液体积的平均值;
根据高锰酸钾和亚硫酸氢钠之间的关系式计算亚硫酸氢钠的物质的量浓度.
解答:
解:(1)1mol高锰酸根离子参加氧化还原反应得到5mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是10,则高锰酸根离子的计量数是2,亚硫酸氢根离子的计量数是5,其它原子根据原子守恒来配平,所以该方程式为:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O;
故答案为:2,5,1,2,5,3;
(2)KMnO4溶液能够腐蚀橡胶,应该用酸式滴定管盛装;滴定完成时NaHSO3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去,就说明NaHSO3溶液已完全被氧化;
故答案为:酸式滴定管;溶液由无色变浅红色,且半分钟内不褪去;
(3)A、酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故A正确;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响,故B错误;
C、定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故C正确;
D、观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故D错误;
故答案为:AC;
(4)实验2中KMnO4溶液的体积的偏离较大,舍去不用,由实验1和3取平均值,KMnO4溶液体积的平均值=
=16.00mL,
设亚硫酸氢钠的物质的量浓度为xmol/L.
2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O.
2mol 5mol
0.0016mol 0.02Cmol
C=O.2
故答案为:16.00;0.2.
故答案为:2,5,1,2,5,3;
(2)KMnO4溶液能够腐蚀橡胶,应该用酸式滴定管盛装;滴定完成时NaHSO3溶液没有剩余,溶液会呈高锰酸钾溶液的颜色,且半分钟内颜色不褪去,就说明NaHSO3溶液已完全被氧化;
故答案为:酸式滴定管;溶液由无色变浅红色,且半分钟内不褪去;
(3)A、酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故A正确;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响,故B错误;
C、定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故C正确;
D、观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故D错误;
故答案为:AC;
(4)实验2中KMnO4溶液的体积的偏离较大,舍去不用,由实验1和3取平均值,KMnO4溶液体积的平均值=
| 15.98mL+16.02mL |
| 2 |
设亚硫酸氢钠的物质的量浓度为xmol/L.
2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O.
2mol 5mol
0.0016mol 0.02Cmol
C=O.2
故答案为:16.00;0.2.
点评:本题考查了物质的量的有关计算、离子方程式的配平等知识点,根据氧化还原反应中得失电子数相等来配平即可,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列两种气体的原子数一定相等的是( )
| A、质量相等、密度不等的N2和C2H4 |
| B、等体积等密度的CO和N2 |
| C、等温等体积的O2和Cl2 |
| D、等压等体积的NH3和CO2 |
下列物质转化在给定条件下能实现的是:
①Al2O3
NaAlO2(aq)
Al(OH)3
②Na→Na2O2→NaOH→Na2CO3
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe3O4
FeCl2→Fe(OH)2→Fe(OH)3
⑤MgCl2(aq)
Mg(OH)2
MgO.
①Al2O3
| NaOH |
| △ |
| CO2 |
②Na→Na2O2→NaOH→Na2CO3
③饱和NaCl(aq)
| NH3,CO2 |
| △ |
④Fe3O4
| HCl溶液 |
⑤MgCl2(aq)
| 石灰乳 |
| 煅烧 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①②③⑤ |
下列关于混合物分离的方法中,能够分离KNO3和NaCl的是( )
| A、溶解过滤 | B、结晶 |
| C、蒸馏 | D、萃取 |
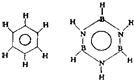 巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( ) 1mol C6H6与H2加成时:Ⅰ需
1mol C6H6与H2加成时:Ⅰ需 立体结构:该结构的二氯代物有
立体结构:该结构的二氯代物有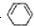 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯