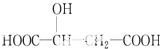题目内容
8.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.荷兰科学家Henk Van Lubeck 引入了酸度(AG)的概念,即把酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[c(H+)/c(OH-)].下列有关叙述中,正确的是( )| A. | 在25℃时,AG=10的溶液呈碱性 | |
| B. | 在25℃时,若溶液呈中性,则pH=7,AG=1 | |
| C. | 在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) | |
| D. | 在25℃时,0.1 mol•L-1 NaOH溶液AG=0 |
分析 25℃时,KW=c(H+)×c(OH-)=10-14,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=lg$\frac{\frac{C({H}^{+})}{1{0}^{-14}}}{C({H}^{+})}$=2(7-pH),pH=7时,c(H+)=c(OH-),AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=lg1=0,pH<7时,溶液呈酸性,c(H+)>c(OH-),AG>0,溶液呈碱性时,pH<7,c(H+)<c(OH-),AG<0,以此解答该题.
解答 解:A.AG=10,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,c(H+)>c(OH-),溶液呈酸性,故A错误;
B.在25℃时,若溶液呈中性,c(H+)=c(OH-)=1×10-7mol•L-1,pH=-lgc(H+)=lg(10-7)=7,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=lg1=0,故B错误;
C.在25℃时,KW=c(H+)×c(OH-)=10-14,c(OH-)=$\frac{{K}_{W}}{C({H}^{+})}$,PH=-lgc(H+),根据AG和pH的计算公式可得AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=lg$\frac{\frac{C({H}^{+})}{1{0}^{-14}}}{C({H}^{+})}$=2(7-pH),故C正确;
D.在25℃时,0.1 mol•L-1 NaOH溶液c(OH-)=1×10-1mol•L-1,c(H+)=1×10-13mol•L-1,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=-12,故D错误.
故选C.
点评 本题考查溶液PH的计算,为高频考点,侧重于学生的分析、计算能力的考查,答题时注意把握对AG的理解,注意处理好有关PH计算的几个关系式,题目难度中等.

| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3-O-CH3 | D. | CH3CHO |
| A. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度,即使条件改变,该限度都不会改变 | |
| D. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
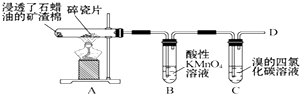
| A. | A装置中碎瓷片的作用是做催化剂 | B. | B、C试管中的溶液均要褪色 | ||
| C. | B、C试管中均发生的是加成反应 | D. | 在D处点燃前,一定要先验纯 |
| A. | 氮气的电子式: | B. | 溴化钠的电子式: | ||
| C. | 乙醛的结构简式:CH2COH | D. | 次氯酸的化学式:HClO |
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 离子化合物可能含共价键,共价化合物可能含离子键 | |
| C. | 任何单质中一定含共价键 | |
| D. | 离子键的本质就是阴阳离子间的静电引力 |
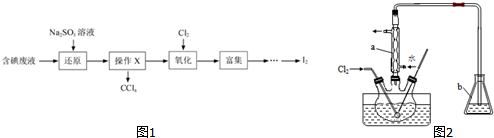
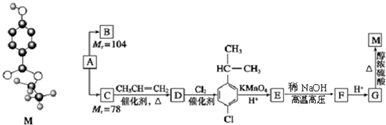
 .
.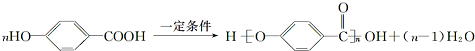 .
.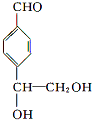 等.
等.